Natria citrato
| Natria citrato | ||

| ||
| Kemia strukturo de la Natria citrato | ||

| ||
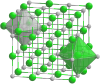
| Tridimensia kemia strukturo de la Natria citrato | ||

| ||
| Travideblaj kristaloj de natria citrato | ||
| Kemia formulo | ||
| CAS-numero-kodo | 68-04-2 | |
| ChemSpider kodo | 5989 | |
| PubChem-kodo | 6224 | |
| Fizikaj proprecoj | ||
| Aspekto | Kristala blanka pulvoro | |
| Molmaso |
| |
| Denseco | 1,76 g/cm3 | |
| Fandopunkto | >300 °C hidratoj perdas akvon supere al 150 C | |
| Bolpunkto | malkomponiĝas | |
| Solvebleco | Akvo:92 g/100 g H2O (25 °C) (kvinhidrata) | |
| Mortiga dozo (LD50) | 1548 mg/kg (muso, buŝa) | |
| Sekurecaj Indikoj | ||
| Risko | R37/38 R41 R36/37/38 | |
| Sekureco | S26 S36/37/39 S24/25 S36 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335, H351, H373 | |
| GHS Deklaroj pri antaŭgardoj | P264, P280, P305+351+338, P313 | |
(25 °C kaj 100 kPa) | ||
Natria citrato, citrato de natrio tribaza aŭ Na3C6H5O7 estas organika salo el citrata acido kaj amonia hidroksido, kiu posedas milde salecan acidogustan, estas iomete baza kaj, kune kun citrata acido ĝi povas uzatis por krei bufrojn[1] biologie akordigeblajn.
Aplikoj[redakti | redakti fonton]
Nutrado[redakti | redakti fonton]
Nitrata citrato uzatas ĉefe kiel nutro-aldonaĵo, kutime kiel gustigilo aŭ konservanto, kaj identiĝas kiel E nombro E331. Citrato de natrio uzatas kiel gustiga agento en certaj variaĵoj da trinkaĵoj kun karbona duoksido. Ĝi same estas ordinara ingredienco en certas specioj da kolbaso kaj ankaŭ uzatas komerce en kelkaj dolĉaj trinkaĵoj kaj miksaĵoj da drinkaĵoj, donante la respektivan acidan guston. Ĝi same uzatas en glaciaĵoj, konfitaĵoj, dolĉaĵoj, pulvora lakto, procezitaj fromaĝoj kaj vino.
Bufro[redakti | redakti fonton]
Kiel konjuga bazo de malforta acido, citrato povas agi kiel bufragento aŭ acideco-kontrolanto, kiu rezistas al ŝanĝoj de pH. Natria citrato uzatas por kontrolado de acideco en kelkaj substancoj, tiel kiel kelkaj ĵeleoj. Ĝi same trovatas en etaj laktujoj uzataj kun kafo-maŝinoj. La kombinaĵo estas ingredienco de kelkaj komercaj anti-acidoj, kiuj estas akvodissoveblaj. Solvaĵo da 5 gramoj/100 ml da akvo ĉe 25 °C prezentas pH inter 7,5-9.0.
Medicino[redakti | redakti fonton]
En 1914, la belga kuracisto Dro. Albert Hustin (1882-1967) kaj la argentina esploristo Luis Agote (1868-1954) sukcese uzis natrian citraton kiel anti-koagulanton en sango-transfuzoj. Ĝi daŭre uzatas ĝis la hodiaŭaj tagoj en plastaj sakoj por sangokolektado kaj por prezervado de sango en sango-bankoj. La citrata jono kelatigas la kalciajn jonojn en la sango estigante kompleksajn kalciajn citratojn, malpermesante la sangokoaguliĝa mekanismo.
En 2003, Dro. Oöpik kaj aliaj, elmontris ke la uzo de natria citrato (0,5 gramoj po kg de korpo-pezo) plibonigas la kurado-plenumon pli ol 5 km po 30 sekundoj.
Natria citrato uzatas por malpezigi la malkomfortojn en urinsistemo, samkiel cistito[2], por redukti la acidozon en dista rentuba acidozo, kaj same uzatas kiel osmoza laksigilo. Ĝi estas la ĉefa komponaĵo por la terapio per buŝa rehidratigo[3].
Ĝi uzatas kiel anti-acido, ĉefe antaŭ ol anestezado, en la procedoj pri Cezara sekco, por reduktado de riskoj asociiĝintaj al aspirado de gastraj enhavaĵoj.
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Preparado de natria citrato per neŭtraligo de la citrata acido kun natria hidroksido:
Reakcio 2[redakti | redakti fonton]
- Preparado de natria citrato per acida transesterigo:
Reakcio 3[redakti | redakti fonton]
- Preparado de natria citrato per estera transesterigo:
Reakcio 4[redakti | redakti fonton]
- Preparado de natria citrato per acida transesterigo:
Reakcio 5[redakti | redakti fonton]
- Kidrolizo de natria citrato:
Literaturo[redakti | redakti fonton]
- Materials Syntheses: A Practical Guide, Ulrich Schubert, Nicola Hüsing, Richard Laine
- Textbook Of Practical Physiology - 2Nd Edn., G.K. & Pal, Pal, Pravati
- Technology of Dairy Products, Ralph Early
- Essential Guide to Food Additives, Mike Saltmarsh, Sue Barlow
- Handbook of Food Fortification and Health: From Concepts to Public Health ..., Victor R. Preedy, Rajaventhan Srirajaskanthan, Vinood B. Patel
- Citric Acid, Alexander Apelblat
- Fundamentals of Cheese Science, P. F. Fox
- Sigma Aldrich
- Chemical Book
| ||||||
Vidu ankaŭ[redakti | redakti fonton]
Referencoj[redakti | redakti fonton]
- ↑ Laŭ PIV, bufro estas substanco aŭ solvaĵo, kiu havas la econ igi la pH-on konstanta malgraŭ aldono de pli acidaj aŭ pli alkalaj substancoj.
- ↑ Kistito estas infekto kiuj tuŝas la urinsistemon, kies flankaj simptomoj estas dolora urinado, febro aŭ lateraj doloroj.
- ↑ Terapio per buŝa rehidratigo estas strategio por fluida anstataŭado uzata por preventado aŭ traktado de senhidratiĝo.





![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)








![{\displaystyle {\mathsf {{\xrightarrow[{}]{3\;H_{2}O}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2bac0b1e5a8f5c96a4bb10a63e80e58a69f41eaf)