Ubikvitino

Ubikvitino estas eta proteino troviĝanta en ĉiuj eŭkariotaj ĉeloj (tial ilia latindevena nomo, el la vorto ubīque, kiu signifas ĉiuloke). Ĝia ĉefa funkcio estas markado de aliaj proteinoj por ilia posta malkombino (procezo konata kiel proteinolizo).
Historio[redakti | redakti fonton]
Ubikvitino estis identigita unufoje en 1975; tiutempe oni nur sciis, ke temis pri proteino kun maso ĉirkaŭ 8.5 kDa kDa trovebla en preskaŭ ĉiuj ĉeloj, sed oni sciis nenion pri ĝia funkcio. Dum la 1980-aj jaroj Aaron Ciechanover, Avram Hershko, kaj Irwin Rose klarigis ĝian funkcion, kaj pro tiu ĉi tasko ili meritis la 2004-an Nobel-premion pri kemio.
Primara strukturo[redakti | redakti fonton]
Ubikvitino konsistas el 76 aminoacidoj kun relativa atommaso de ĉ. 8.5 kDa. La sinsekvo estas unu el la plej difinita en la naturo, kaj apenaŭ okazas mutacioj en ĝi. La sekvenco de specioj sufiĉe apartaj, kiel ekzemple gisto kaj homo, diferenciĝas nur tri nukleotidoj:
gista ubikvitino[1]: MQIFVKTLTGKTITLEVESSDTIDNVKSKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG homa ubikvitino[2]: MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG
Funkcio kaj agado[redakti | redakti fonton]
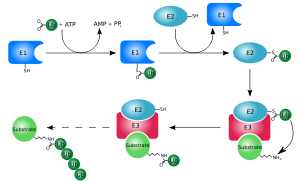
Kiel oni diris, la ĉefa konata funkcio de ubikvitino estas proteinolizo. La ubikvitinigado, aŭ markado de proteino per ubikvitino havas la sekvajn paŝojn:
- Aktivigo de ubikvitino: la karboksila grupo de la fina glicino de ubikvitino ligiĝas al sulfohidrila grupo -SH de ubikvitino-aktiviga enzimo, konata kiel E1. Tiu paŝo bezonas ATP-on kiel energifonton kaj rezultas tioesteran ligon inter ubikvitino kaj enzimo E1.
- Transfero de ubikvitino de E1 al ubikvitin-kunliga enzimo E2.
- La fina transfero de ubikvitino al la markita proteino povas okazi
- direkte de E2, kiu estas la ĉefa vojo, se ubikvitino estas transportita al alia ubikvitino, formante ĉenon.
- aŭ
- tra vojo al enzimo E3, kiu ligas speciale al E2 kaj markita proteino. Tio estas la normala vojo por marki la specifan proteinon por proteolizo. Ubikvitino ligiĝas al lizino ĉe la celita proteino.
Finfine, la markita proteino digestiĝas en la 26S-proteasomo al etaj peptidoj, aminoacidoj, kaj ubikvitino (kiu povas reuziĝi). Nuntempe oni ne sufiĉe bone scias, kial ubikvitino ne estas malkombinigita en la proteazomo kun la aliaj proteinoj.
E1 (ubikvitin-aktiviga enzimo) kaj E2 (ubikvitin-konjugita enzimo) estas kutime sufiĉe bone konservitaj proteinoj, dum E3 (ubikvitin-ligazo) ne estas ununura proteino sed granda familio de proteinoj, kaj fakte kelkfoje unu enzimo E3 partoprenas en digestigado de nur unu speciala proteino kaj ne aliaj.
Malsanoj rilate al ubikvitino[redakti | redakti fonton]
Plurfoje, mutacioj aŭ malbona regulado de ubikvitino rilatas al diversaj malsanoj. Jen la ĉefaj, kiujn oni konas:
