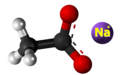
Acetato
| Acetato | |
 | |
Acetato aŭ H3C-COO- estas salo formita el la kombinado de acetata acido kun bazo (ekzemple: alkala, teralkala, metala, nemetala aŭ bazradikalo.
"Acetato" ankaŭ priskribas la konjugaciitan bazon aŭ jonon (specife, la negative ŝargitan jonon nomitan anjono) tipe trovatan en akva solvaĵo kaj skribita kun la kemia formulo C2H3O. La neŭtralaj molekuloj formitaj per la kombinaĵo de la acetata jono kaj pozitiva jono (nomita katjono) ankaŭ estas ofte nomitaj "acetatoj" (tial, acetato de plumbo, acetato de aluminio, acetato de kupro (I), ktp.). La plej simpla el tiuj estas hidrogena acetato (nomita acetata acido) kun respektivaj saloj, esteroj, kaj la poliatoma anjono CH3CO2H, aŭ CH3COO-.
La plej multaj el la proksimume 5 miliardoj da kilogramoj je acetata acido produktataj ĉiujare en industrio estas uzataj en la produktado de acetatoj, kiuj kutime prenas la formon de polimeroj. En naturo, acetato estas la plej ofta konstrublokoj por biosintezo.
Saloj[redakti | redakti fonton]

La acetata anjono, [CH3COO]−,(aŭ [C2H3 O2]−) estas unu el la familio de la karboksilatoj. Ĝi estas la konjuga bazo de acetata acido. Super pH de 5.5, acetata acido transformas al acetato:
Multaj acetataj saloj estas jonaj, indikitaj per ilia tendenco bone dissolviĝi en akvo. Ofte renkontita acetato en la hejmo estas natria acetato, blanka solidaĵo kiu povas esti preparita kombinante vinagron kaj natria bikarbonato ("natria bikarbonato"):
- Preparado de natria acetato per traktado de natria bikarbonato kun acetata acido:[1]
Transirmetaloj povas formi kompleksaĵojn per acetato. Ekzemploj de acetataj kompleksaĵoj inkludas kromon (II) acetaton kaj bazan zinkan acetaton.
Komerce gravaj acetataj saloj estas aluminia acetato, uzata en tinkturfarbado, amonia acetato, antaŭaĵo de la acetamido, kaj kalia acetato, uzata kiel diurezigilo. Ĉiuj tri saloj estas senkoloraj kaj tre solveblaj en akvo.
Esteroj[redakti | redakti fonton]
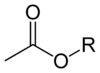
Acetataj esteroj havas la ĝeneralan formulon CH3CO2R, kie R estas la anstataŭa grupo. La esteroj estas la superregantaj formoj de acetato en la merkato. Male al la acetataj saloj, acetataj esteroj ofte estas likvaj, lipofilaj, kaj foje volatilaj. Ili estas popularaj ĉar ili havas neofendajn, ofte dolĉajn odorojn, ili estas malmultekostaj, kaj ili estas kutime malalte toksaj.
Preskaŭ duono de la produktado de acetata acido estas konsumita en la produktado de vinila acetato, antaŭaĵo de la polivinila alkoholo, kiu estas komponanto de multaj farboj. La dua plej granda uzo de acetata acido estas konsumita en la produktado de celuloza acetato. Fakte, "acetato" estas ĵargono por celuloza acetato, kiu estas uzata en la produktado de fibroj aŭ diversaj produktoj, ekz. la acetataj diskoj uzataj en sona diskoproduktado. Celuloza acetato troviĝas en multaj hejmaj produktoj. Multaj industriaj solvantoj estas acetatoj, inkluzive de metila acetato, etila acetato, izopropila acetato, etila heksila acetato. Butila acetato estas bonodora kaj uzata en manĝaĵoj.
Acetatoj[redakti | redakti fonton]
- Alila acetato
- Amila acetato
- Izoamila acetato
- Anizila acetato
- Benzila acetato
- Bornila acetato
- Izobornila acetato
- n-Butila acetato
- 2-Butila acetato
- Izobutila acetato
- t-Butila acetato
- Butirila acetato
- Izobuterila acetato
- Cedrila acetato
- Cinamila acetato
- Citronelila acetato
- Dekila acetato
- Tetradekila acetato
- Etila acetato
- Etila benzoilacetato
- Eŭgenila acetato
- Izoeŭgenila acetato
- Izoeŭgenila acetato
- Farnezila acetato
- Fenacila acetato
- Fenetila acetato
- Fenila acetato
- Fenilacetata acido
- Fenilpropila acetato
- Formila acetato
- Furfurila acetato
- Geranila acetato
- Heksila acetato
- Cikloheksila acetato
- Izoheksila acetato
- Heptila acetato
- Cikloheptila acetato
- Izoheptila acetato
- Kalcia acetato
- Kalia acetato
- Ciklolaŭrila acetato
- Laŭrila acetato
- Linalila acetato
- Litia acetato
- Mentila acetato
- Metila acetato
- Mircenila acetato
- Miristila acetato
- Natria acetato
- Nerila acetato
- Nitrozila acetato
- Izopentila acetato
- Ciklopentila acetato
- Izopropenila acetato
- Propila acetato
- Izopropila acetato
- Pulegila acetato
- Izopulegila acetato
- α-Terpinila acetato
- Vinila acetato
Kloroacetatoj[redakti | redakti fonton]
- Natria kloroacetato
- Kalia kloroacetato
- Metila kloroacetato
- Etila kloroacetato
- Propila kloroacetato
- Alila kloroacetato
- Benzila kloroacetato
- Fenila kloroacetato
- Kloroetila kloroacetato
- Metoksofenila kloroacetato
- Klorometila kloroacetato
- Izopropila kloroacetato
- Butila kloroacetato
- Izobutila kloroacetato
- t-Butila kloroacetato
- Sek-butila kloroacetato
Dukloroacetatoj[redakti | redakti fonton]
- Alila dukloroacetato
- Amila dukloroacetato
- Benzila dukloroacetato
- Butila dukloroacetato
- Sek-Butila dukloroacetato
- Izobutila dukloroacetato
- t-Butila dukloroacetato
- Cickloheksila dukloroacetato
- Cickloheptila dukloroacetato
- Cicklopentila dukloroacetato
- Etila dukloroacetato
- Fenila dukloroacetato
- Heksila dukloroacetato
- Heptila dukloroacetato
- Izopropila dukloroacetato
- Kalia dukloroacetato
- Kloroetila dukloroacetato
- Klorometila dukloroacetato
- Metila dukloroacetato
- Metoksofenila dukloroacetato
- Natria dukloroacetato
- Pentila dukloroacetato
- Propila dukloroacetato
- Izopropila dukloroacetato
- Vinila dukloroacetato
Trikloroacetatoj[redakti | redakti fonton]
- Alila trikloroacetato
- Amila trikloroacetato
- Benzila trikloroacetato
- Butila trikloroacetato
- Izobutila trikloroacetato
- Sek-butila trikloroacetato
- t-Butila trikloroacetato
- Cikloheksila trikloroacetato
- Cikloheptila trikloroacetato
- Ciklopentila trikloroacetato
- Etila trikloroacetato
- Fenila trikloroacetato
- Heksila trikloroacetato
- Heptila trikloroacetato
- Kalia trikloroacetato
- Kloroetila trikloroacetato
- Klorometila trikloroacetato
- Metila trikloroacetato
- Metoksofenila trikloroacetato
- Natria trikloroacetato
- Pentila trikloroacetato
- Propila trikloroacetato
- Izopropila trikloroacetato
- Vinila trikloroacetato
Jodoacetatoj[redakti | redakti fonton]
- Alila jodoacetato
- Benzila jodoacetato
- Butila jodoacetato
- Izobutila jodoacetato
- Sek-Butila jodoacetato
- t-Butila jodoacetato
- Cikloheksila jodoacetato
- Cikloheptila jodoacetato
- Ciklopentila jodoacetato
- Etila jodoacetato
- Fenila jodoacetato
- Kalia jodoacetato
- Kloroetila jodoacetato
- Klorometila jodoacetato
- Metila jodoacetato
- Metoksofenila jodoacetato
- Natria jodoacetato
- Propila jodoacetato
- Izopropila jodoacetato
- Vinila jodoacetato
Dujodoacetatoj[redakti | redakti fonton]
Trijodoacetatoj[redakti | redakti fonton]
- Alila trijodoacetato
- Amila trijodoacetato
- Izoamila trijodoacetato
- Benzila trijodoacetato
- Butila trijodoacetato
- Izobutila trijodoacetato
- Sek-butila trijodoacetato
- t-Butila trijodoacetato
- Etila trijodoacetato
- Fenila trijodoacetato
- Kalia trijodoacetato
- Metila trijodoacetato
- Natria trijodoacetato
- Izopropila trijodoacetato
- Propila trijodoacetato
Bromoacetatoj[redakti | redakti fonton]
- Alila bromoacetato
- Amila bromoacetato
- Izoamila bromoacetato
- Benzila bromoacetato
- Butila bromoacetato
- Izobutila bromoacetato
- Sek-butila bromoacetato
- t-Butila bromoacetato
- Etila bromoacetato
- Fenila bromoacetato
- Kalia bromoacetato
- Metila bromoacetato
- Natria bromoacetato
- Izopropila bromoacetato
- Propila bromoacetato
Dubromoacetatoj[redakti | redakti fonton]
- Alila dubromoacetato
- Amila dubromoacetato
- Izoamila dubromoacetato
- Benzila dubromoacetato
- Butila dubromoacetato
- Izobutila dubromoacetato
- Sek-butila dubromoacetato
- t-Butila dubromoacetato
- Cikloheksila dubromoacetato
- Cikloheptila dubromoacetato
- Ciklopentila dubromoacetato
- Dekila dubromoacetato
- Dodekila dubromoacetato
- Undekila dubromoacetato
- Etila dubromoacetato
- Fenila dubromoacetato
- Heksila dubromoacetato
- Heptila dubromoacetato
- Kalia dubromoacetato
- Metila dubromoacetato
- Natria dubromoacetato
- Dubromoacetila 2-piridino
- Nonila dubromoacetato
- Oktila dubromoacetato
- Piperazine dubromoacetato
- Piperidina dubromoacetato
- Propila dubromoacetato
- Izopropila dubromoacetato
- Pirolidina dubromoacetato
Tribromoacetatoj[redakti | redakti fonton]
- Alila tribromoacetato
- Amila tribromoacetato
- Izoamila tribromoacetato
- Benzila tribromoacetato
- Butila tribromoacetato
- Ciklododekila tribromoacetato
- Cikloheksila tribromoacetato
- Cikloheptila tribromoacetato
- Ciklopentila tribromoacetato
- Dekila tribromoacetato
- Dodekila tribromoacetato
- Etila tribromoacetato
- Fenila tribromoacetato
- Heksila tribromoacetato
- Heptila tribromoacetato
- Izoamila tribromoacetato
- Izobutila tribromoacetato
- Izopentila tribromoacetato
- Izopropila tribromoacetato
- Kalia tribromoacetato
- Metila tribromoacetato
- Natria tribromoacetato
- Nonila tribromoacetato
- Oktila tribromoacetato
- Pentila tribromoacetato
- Piperazina tribromoacetato
- Piperidina tribromoacetato
- Pirolidina tribromoacetato
- Propila tribromoacetato
- Sek-butila tribromoacetato
- t-Butila tribromoacetato
- tribromoacetata acido
- Undekila tribromoacetato
Fluoroacetatoj[redakti | redakti fonton]
- Alila fluoroacetato
- Amila fluoroacetato
- Izoamila fluoroacetato
- Benzila fluoroacetato
- Butila fluoroacetato
- Ciklododekila fluoroacetato
- Cikloheksila fluoroacetato
- Cikloheptila fluoroacetato
- Ciklopentila fluoroacetato
- Dekila fluoroacetato
- Dodekila fluoroacetato
- Etila fluoroacetato
- Fenila fluoroacetato
- Heksila fluoroacetato
- Heptila fluoroacetato
- Izoamila fluoroacetato
- Izobutila fluoroacetato
- Izopentila fluoroacetato
- Izopropila fluoroacetato
- Kalia fluoroacetato
- Metila fluoroacetato
- Natria fluoroacetato
- Nonila fluoroacetato
- Oktila fluoroacetato
- Pentila fluoroacetato
- Piperazina fluoroacetato
- Piperidina fluoroacetato
- Pirolidina fluoroacetato
- Propila fluoroacetato
- sek-Butila fluoroacetato
- t-Butila fluoroacetato
- fluoroacetata acido
- Undekila fluoroacetato
Dufluoroacetatoj[redakti | redakti fonton]
- Alila dufluoroacetato
- Amila dufluoroacetato
- Izoamila dufluoroacetato
- Benzila dufluoroacetato
- Butila dufluoroacetato
- Ciklododekila dufluoroacetato
- Cikloheksila dufluoroacetato
- Cikloheptila dufluoroacetato
- Ciklopentila dufluoroacetato
- Dekila dufluoroacetato
- Dodekila dufluoroacetato
- Etila dufluoroacetato
- Fenila dufluoroacetato
- Heksila dufluoroacetato
- Heptila dufluoroacetato
- Izoamila dufluoroacetato
- Izobutila dufluoroacetato
- Izopentila dufluoroacetato
- Izopropila dufluoroacetato
- Kalia dufluoroacetato
- Metila dufluoroacetato
- Natria dufluoroacetato
- Nonila dufluoroacetato
- Oktila dufluoroacetato
- Pentila dufluoroacetato
- Piperazina dufluoroacetato
- Piperidina dufluoroacetato
- Pirolidina dufluoroacetato
- Propila dufluoroacetato
- sek-Butila dufluoroacetato
- t-Butila dufluoroacetato
- dufluoroacetata acido
- Undekila dufluoroacetato
Trifluoroacetatoj[redakti | redakti fonton]
- Alila trifluoroacetato
- Amila trifluoroacetato
- Izoamila trifluoroacetato
- Benzila trifluoroacetato
- Butila trifluoroacetato
- Ciklododekila trifluoroacetato
- Cikloheksila trifluoroacetato
- Cikloheptila trifluoroacetato
- Ciklopentila trifluoroacetato
- Dekila trifluoroacetato
- Dodekila trifluoroacetato
- Etila trifluoroacetato
- Fenila trifluoroacetato
- Heksila trifluoroacetato
- Heptila trifluoroacetato
- Izoamila trifluoroacetato
- Izobutila trifluoroacetato
- Izopentila trifluoroacetato
- Izopropila trifluoroacetato
- Kalia trifluoroacetato
- Metila trifluoroacetato
- Natria trifluoroacetato
- Nonila trifluoroacetato
- Oktila trifluoroacetato
- Pentila trifluoroacetato
- Piperazina trifluoroacetato
- Piperidina trifluoroacetato
- Pirolidina trifluoroacetato
- Propila trifluoroacetato
- sek-Butila trifluoroacetato
- t-Butila trifluoroacetato
- trifluoroacetata acido
- Undekila trifluoroacetato
Fenilacetatoj[redakti | redakti fonton]
- Alila fenilacetato
- Amila fenilacetato
- Izoamila fenilacetato
- Anizila fenilacetato
- Benzila fenilacetato
- Butila fenilacetato
- Izobutila fenilacetato
- Citronelila fenilacetato
- Eŭgenila fenilacetato
- Farnezila fenilacetato
- Fenila fenilacetato
- Furfurila fenilacetato
- Geranila fenilacetato
- Heksila fenilacetato
- Cikloheksila fenilacetato
- Heptila fenilacetato
- Cikloheptila fenilacetato
- Linalila fenilacetato
- Miristila fenilacetato
- Nerila fenilacetato
- Propila fenilacetato
- Izopropila fenilacetato
- Amila fenilacetato
- Ciklopentila fenilacetato
- Vinila fenilacetato
Nitroacetatoj[redakti | redakti fonton]
Aminoacetatoj[redakti | redakti fonton]
Indoloacetatoj[redakti | redakti fonton]
Hidroksoacetatoj[redakti | redakti fonton]
- Alila izoamila hidroksoacetato
- Alila hidroksoacetato
- Amila hidroksoacetato
- Benzila hidroksoacetato
- Butila hidroksoacetato
- Izobutila hidroksoacetato
- Sek-butila hidroksoacetato
- t-Butila hidroksoacetato
- Dekila hidroksoacetato
- Dodekila hidroksoacetato
- Undekila hidroksoacetato
- Etila hidroksoacetato
- Fenila hidroksoacetato
- Cikloheksila hidroksoacetato
- Heksila hidroksoacetato
- Cikloheptila hidroksoacetato
- Heptila hidroksoacetato
- Kalia hidroksoacetato
- Metila hidroksoacetato
- Natria hidroksoacetato
- Nonila hidroksoacetato
- Oktila hidroksoacetato
- Ciklopentila hidroksoacetato
- Propila hidroksoacetato
- Izopropila hidroksoacetato
Cianoacetatoj[redakti | redakti fonton]
- Alila cianoacetato
- Amila cianoacetato
- Izoamila cianoacetato
- Benzila cianoacetato
- Butila cianoacetato
- Izobutila cianoacetato
- Sek-Butila cianoacetato
- t-Butila cianoacetato
- Dekila cianoacetato
- Dodekila cianoacetato
- Undekila cianoacetato
- Etila cianoacetato
- Fenila cianoacetato
- Cikloheksila cianoacetato
- Heksila cianoacetato
- Cikloheptila cianoacetato
- Heptila cianoacetato
- Kalia cianoacetato
- Metila cianoacetato
- Natria cianoacetato
- Nonila cianoacetato
- Oktila cianoacetato
- Ciklopentila cianoacetato
- Propila cianoacetato
- Izopropila cianoacetato
Acetoacetatoj[redakti | redakti fonton]
- Alila acetoacetato
- Amila acetoacetato
- Izoamila acetoacetato
- Benzila acetoacetato
- Butila acetoacetato
- Izobutila acetoacetato
- Sek-Butila acetoacetato
- t-Butila acetoacetato
- Dekila acetoacetato
- Dodekila acetoacetato
- Undekila acetoacetato
- Etila acetoacetato
- Fenila acetoacetato
- Cikloheksila acetoacetato
- Heksila acetoacetato
- Cikloheptila acetoacetato
- Heptila acetoacetato
- Kalia acetoacetato
- Metila acetoacetato
- Natria acetoacetato
- Nonila acetoacetato
- Oktila acetoacetato
- Ciklopentila acetoacetato
- Propila acetoacetato
- Izopropila acetoacetato



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)