Akacetino
| Akacetino | ||
 | ||
| Plata kemia strukturo de la Akacetino | ||
 | ||
| Tridimensia kemia strukturo de la Akacetino | ||
 | ||
| Akacetino estas polifenola komponaĵo kun antiinflamaj kaj antioksidigaj proprecoj trovata en la mielo.[1] | ||
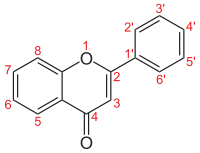 | ||
| Numerigo de la karbonaj strukturoj de la flavonoj. | ||
| Kemia formulo | ||
| CAS-numero-kodo | 480-44-4 | |
| ChemSpider kodo | 4444099 | |
| PubChem-kodo | 5280442 | |
| Merck Index | 15,14 | |
| Fizikaj proprecoj | ||
| Aspekto | senkolora solidaĵo | |
| Molmaso | 284,2635 g·mol−1 | |
| Denseco | 1,216g cm−3 | |
| Fandpunkto | 260 °C−265 °C[2] | |
| Bolpunkto | 518,6 °C[3] | |
| Refrakta indico | 1 669 | |
| Ekflama temperaturo | 198,2 °C[4] | |
| Acideco (pKa) | 6,51 | |
| Solvebleco | Akvo:0,056 g/L [5] | |
| Mortiga dozo (LD50) | 3600 mg/kg (buŝe)[6] | |
| Sekurecaj Indikoj | ||
| Riskoj | R36/37/38 | |
| Sekureco | S26 S36 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P321, P332+313, P337+313, P362, P403+233, P405, P501[7] | |
(25 °C kaj 100 kPa) | ||
Akacetino, (5,7-duhidrokso-4'metokso-flavono) aŭ C16H12O5 estas kemia kombinaĵo apartenanta al la familio de la flavonoidoj nature okazantaj en plantoj tiaj kiaj Robinia pseudoacacia, Turnera diffusa, Betula pendula, kaj Asplenium normale. Akacetino ordinare estas senkolora aŭ blanka solidaĵo, sed en alkala medio ĝi iĝas ruĝa.
Ĝi estas nesolvebla en akvo kaj duetila etero sed solvebla en varma etanolo. Biologie, akacetino posedas antiinflamajn, antiperoksidigajn, antimutagenajn kaj antikancerajn proprecojn per forigado kaj detruado de la invadantaj kancerĉeloj en homoj. Eksperimentoj elmontras ke buŝadministrado de akacetino agas kiel potence antikancera aktiveco rezultante en apoptozon.
Kiel fenola komponaĵo, ĝi apartenas al grupo da substancoj enhavantaj pli ol 8 mil kemiajn strukturojn ekde simplaj fenolaj molekuloj ĝis polimeroj kun altaj molekulpezoj, kun antiinflamaj, antidoloraj, antivirusaj, antibiotikaj kaj korvaskulaj aktivecoj.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado ekde la apigenino per anstataŭado de la hidroksila grupo je metoksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 2[redakti | redakti fonton]
- Preparado ekde la miriketino per forigado de tri hidroksilaj grupoj, nome, unu en la 3-a pozicio de la kromenonila radikalo, kaj du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila grupo, sekvata per anstataŭado de la hidroksila grupo je metoksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 3[redakti | redakti fonton]
- Preparado ekde la luteolino per forigado de unu hidroksila grupo en la 5-a pozicio de la fenila grupo, sekvata per anstataŭado de la hidroksila grupo je metoksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 4[redakti | redakti fonton]
- Preparado ekde la kverketino per forigado de du hidroksilaj grupoj, nome, unu en la 3-a pozicio de la kromenonila radikalo, kaj alia en la 5-a pozicio de la fenila grupo, sekvata per anstataŭado de la hidroksila grupo je metoksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 5[redakti | redakti fonton]
- Preparado ekde la naringenino per anstataŭado de la hidroksila grupo je metoksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 6[redakti | redakti fonton]
- Preparado ekde la krizino per aldono de metoksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 7[redakti | redakti fonton]
- Preparado ekde la kempferolo per forigado de unu hidroksila grupo en la 3-a pozicio de la kromenonila radikalo, kaj anstataŭado de la hidroksila grupo je metoksila grupo en la 4-a pozicio de la fenila grupo:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Konvertado al apigenino per anstataŭado de la metoksila grupo hidroksila grupo je en la 4-a pozicio de la fenila grupo:
Reakcio 2[redakti | redakti fonton]
- Konvertado al miriketino per aldono de tri hidroksilaj grupoj, nome, unu en la 3-a pozicio de la kromenonila radikalo, kaj du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila grupo, sekvata per anstataŭado de la metoksila grupo je hidroksila grupo en la 4-a pozicio de la fenila grupo:
Reakcio 3[redakti | redakti fonton]
- Konvertado al luteolino per aldono de unu hidroksila grupo en la 5-a pozicio de la fenila grupo, sekvata per anstataŭado de la metoksila grupo je hidroksila grupo en la 4-a pozicio de la fenila grupo:
Reakcio 4[redakti | redakti fonton]
- Konvertado al kverketino per aldono de du hidroksilaj grupoj, nome, unu en la 3-a pozicio de la kromenonila radikalo, kaj alia en la 5-a pozicio de la fenila grupo, sekvata per anstataŭado de la metoksila grupo je hidroksila grupo en la 4-a pozicio de la fenila grupo:
Reakcio 5[redakti | redakti fonton]
- Konvertado al naringenino per anstataŭado de la metoksila grupo je hidroksila grupo en la 4-a pozicio de la fenila grupo:
Reakcio 6[redakti | redakti fonton]
- Konvertado al "krizino" per forigo de metoksila grupo en la 4-a pozicio de la fenila grupo:
Reakcio 7[redakti | redakti fonton]
- Konvertado al kempferolo per aldono de unu hidroksila grupo en la 3-a pozicio de la kromenonila radikalo, kaj anstataŭado de la metoksila grupo je hidroksila grupo en la 4-a pozicio de la fenila grupo:
Literaturo[redakti | redakti fonton]
- The Good Scents Company
- Isolation and Structure Elucidation of Bioactive Compounds (Dedicated to the ...
- Science Direct
- Hindawi
- Nature
- Ovarian Cancer: New Insights for the Healthcare Professional
- The Complete Book on Fruits, Vegetables and Food Processing
- Natural Antioxidants and Anticarcinogens in Nutrition, Health and Disease





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)






