Amila glikolato
| Amila hidroksoacetato | ||
| Kemia formulo | ||
 | ||
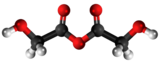
Amila glikolato | ||
 | ||
| Alternativa(j) nomo(j) | ||
| ||
| CAS-numero-kodo | 5426-43-7 | |
| ChemSpider kodo | 195601 | |
| PubChem-kodo | 225038 | |
| Fizikaj proprecoj | ||
| Molmaso | 146,186g mol−1 | |
| Denseco | 1,007 g/cm−3[1] | |
| Bolpunkto | 197,4°C [2] | |
| Refrakta indico | 1,434[3] | |
| Ekflama temperaturo | 78,8°C [4] | |
| Solvebleco | Akvo:nesolvebla | |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Amila glikolato aŭ C7H14O3 estas kemia kombinaĵo rezultanta el interagado de la glikolata acido kun amila alkoholo, senkolora aŭ flaveca likvaĵo uzata en kemiaj sintezoj. Amila glikolato ne estas solvebla en akvo, sed estas solvebla en etanolo, propilena glikolo, kloroformo, eteroj, kaj oleoj.
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Preparado de amila glikolato per traktado de glikolata acido kun amila alkoholo:
Reakcio 2[redakti | redakti fonton]
- Preparado de amila glikolato per traktado de glikolata anhidrido kun amila alkoholo:
Reakcio 3[redakti | redakti fonton]
- Preparado de amila glikolato per traktado de glikolata acido kun amila klorido:
Reakcio 4[redakti | redakti fonton]
- Preparado de amila glikolato per traktado de glikolata anhidrido kun amila klorido:



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)