Butanono
| Butanono | ||||

| ||||
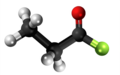
| Plata kemia strukturo de la Butanono | ||||

| ||||
| Tridimensia strukturo de la Butanono | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 78-93-3 | |||
| ChemSpider kodo | 6321 | |||
| PubChem-kodo | 6569 | |||
| Merck Index | 15,6143 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora likvaĵo kun menta aŭ ketona odoro. | |||
| Molmaso | 72.11 g·mol−1 | |||
| Denseco | 0.8054 g cm−3 | |||
| Fandpunkto | −86 °C | |||
| Bolpunkto | 79.64 °C | |||
| Refrakta indico | 1,3788 | |||
| Ekflama temperaturo | −8.9 °C | |||
| Memsparka temperaturo | 505 °C | |||
| Solvebleco | Akvo: | |||
| Mortiga dozo (LD50) | 2737 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Risko | R11 R23/24/25 R36 R39 R66 R67 | |||
| Sekureco | S9 S16 S36/37 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝo | |||
| GHS Deklaroj pri damaĝoj | H225, H315, H319, H332, H335, H336, H371, H371[1] | |||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P280, P302+352, P303+361+353, P304+312, P304+340, P305+351+338, P309+311, P312, P314, P321, P332+313, P337+313, P362, P370+378, P403+233, P403+235, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
Butanono aŭ metil etil ketono (MEK) estas organika kombinaĵo, senkolora likvaĵo, alte brulema, kun forta kaj agrabla dolĉeca odoro. Industrie ĝi produktatas grandskale kaj ankaŭ okazas nature en spurkvantoj. Ĝi estas solvebla en akvo kaj ordinare uzatas kiel industria solvanto kaj kiel katalizilo en la fotopolimerizado de la metakrilata acido.
Butanono estas bonega ordinara solvanto kaj uzatas en procezoj pri fabrikado de gumoj, rezinoj, celuloza acetato, nitrocelulozaj kovraĵoj kaj vinilaj tavoloj. Pro tio, ĝi trovas uzojn en la fabrikado de plastaĵoj, tekstilaĵoj kaj parafina vakso, kaj en dompurigaj produktoj tiaj kiaj lakoj, vernisoj, farbo-forigiloj kaj purigagentoj.
Ĝi posedas similajn proprecojn al acetono sed bolas sub pli alta temperaturo kaj posedas signifoplenan pli malaltan vaporigo-rapidon. Butanono ankaŭ uzatas kiel solvanto de sekaj feltokrajonoj uzataj kiel markigiloj sur kretotabuloj.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
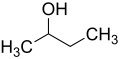
- Preparado de la 2-butanono per oksidado de 2-butanolo:
Sintezo 2[redakti | redakti fonton]
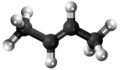
- Preparado de la 2-butanono per hidratigado de la 2-buteno:
Sintezo 3[redakti | redakti fonton]
- Preparado de 2-butanono per traktado de acetila klorido kaj etano:
Sintezo 4[redakti | redakti fonton]
- Preparado de la 2-butanono per traktado de propanoila klorido kaj metano:
Sintezo 5[redakti | redakti fonton]
Hidratigo:* Preparado de la 2-butanono per hidratigado de 1-butino:
Sintezo 6[redakti | redakti fonton]
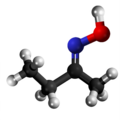
- Preparado de la butanona oksimo per traktado de butanono kaj hidroksilamino sekvata per Rearanĝo de Beckmann en acida medio:
Sintezo 7[redakti | redakti fonton]
- Preparado de la propano per traktado de butanono kaj hidrazino:
Sintezo 8[redakti | redakti fonton]
- Preparado de la butanona cianhidrino per traktado de butanono kaj cianida acido:
Sintezo 9[redakti | redakti fonton]
- Preparado de la butanono per traktado de propanalo kaj klorometano:
Literaturo[redakti | redakti fonton]
- NIST Chemistry WebBook
- Groundwater Chemicals Desk Reference, Fourth Edition, John H. Montgomery
- Chemical Book
- Chemicalland21
- Cameo Chemicals
- Industrial Organic Chemistry, Klaus Weissermel, Hans-Jürgen Arpe
Kunrilataj kemiaĵoj[redakti | redakti fonton]
-
Pinakolono









![{\displaystyle {\mathsf {{\xrightarrow[{-\,H_{2}O}]{KMnO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e3289cab8503fe5d5ce75bc7e6e75c20bc9e36f2)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{H_{2}O}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8391c93795230bfbc6c2fc92e02a606f92b6e478)


![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)


![{\displaystyle {\mathsf {{\xrightarrow[{Beckmann}]{Rearan{\hat {g}}o\,de}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d146dfbcd9455e68134b882e703720cca9ca8c91)