Cianata acido
| Cianata acido | |||||
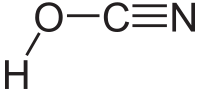 | |||||
| Plata kemia strukturo de la Cianata acido | |||||
 | |||||
| Tridimensia kemia strukturo de la Cianata acido | |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 420-05-3 | ||||
| ChemSpider kodo | 525 | ||||
| PubChem-kodo | 540 | ||||
| Merck Index | 15,2676 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora aŭ blanka senodora likvaĵo | ||||
| Molmaso | 43.025 g·mol-1 | ||||
| Denseco | 1.14g cm−3 | ||||
| Fandpunkto | −81 °C | ||||
| Bolpunkto | 23.5 °C | ||||
| Acideco (pKa) | 3.46[1] | ||||
| Mortiga dozo (LD50) | 91 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R22 R52 R53 | ||||
| Sekureco | S24 S25 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝo | ||||
| GHS Deklaroj pri damaĝoj | H302, H312, H314, H332, H334, H335 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P261, P264, P270, P271, P280, P301+312, P301+330+331, P302+352, P303+361+353, P304+312, P304+340, P304+341, P305+351+338, P310, P312, P321, P330, P342+311, P363, P403+233, P405, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Cianata acido estas unubaza acido, senkolora kaj senodora likvaĵo, solvebla en akvo kaj etero, volatila kaj venena substanco kiu malkomponiĝas kiam hejtata, estigante kun bazoj la respektivajn cianatojn. En akvaj solvaĵoj ĝi inklinas al malkomponado formante karbonan duoksidon kaj amoniakon.
Ĝi estas deirmaterialo en la produktado de farmaciaĵoj kaj herbicidoj derivitaj el la ureo. Ciamelido estas blanka senforma solidaĵo, tute malsolvebla en akvo kaj rezultanta el polimerizo de la cianata acido, kies formulo estas [HCNO]n.
Ciamelido dissolviĝas en sulfata acido sed ne reakcias kun ĝi, sed kiam varmigita en ĉeesto de koncentrita sulfata acido ĝi malkomponiĝas en karbona duoksido kaj amoniako.[2] La cianurata acido estas nur trimero de la cianata acido. En akva solvaĵo, cianata acido estas miksaĵo de la taŭtomeraj formoj, kaj ketonaj kaj enolaj, kiuj polimerizas respektive al cianurata acido kaj ciamelido.
|
Cianata acido estas tre reakciema kaj dissolviĝas en alkoholo donante uretanojn kaj alkilaj alofanatoj. La kristalaj strukturoj de la cianatoj elmontras ke ĉi-jono estas lineara kaj hipoteze ĝi prezentas unu el la eblaj formulaĵoj: H+O-C=N- aŭ H+O=C=N-. Kiam kombinita kun akvo-molekuloj kiel kristaliga-akvo, cianurata acido kapablas estigi grandajn kristalojn. Hidratigita solvaĵo de cianata acido povas spontanee sperti eksplodo-malkomponadon sub ordinara temperaturo, disvolvante grandan varmo-evoluon kaj konvertiĝante en solida maso mirinde blanka.[3]
| Taŭtomeraj formulaĵoj de la cianata acido | ||||||||
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Cianata acido malkomponiĝas en acida medio:
Reakcio 2[redakti | redakti fonton]
- En ĉeesto de klorida acido ĝi donas kloridojn:
Reakcio 3[redakti | redakti fonton]
- Kun eksceso de akvo cianatoj formas ureon:
Reakcio 4[redakti | redakti fonton]
- En ĉeesto de oksidigaĵoj, cianatoj eligas nitrogenon:
Reakcio 5[redakti | redakti fonton]
- Per malkomponado, "etila cianurato" donas cianatan acidon:
Literaturo[redakti | redakti fonton]
- A Dictionary of Chemistry and the Allied Branches of Other Sciences, Volume 2, Henry Watts
- A Manuel of the Chemistry of the Carbon Compounds: Or, Organic Chemistry, Carl Schorlemmer
- The London Lancet: A Journal of British and Foreign Medicine
- Elements of Chemistry
- A Manuel of the Chemistry of the Carbon Compounds, Carl Schorlemmer
- Monocarbonyl Derivatives of Aliphatic Hydrocarbons, Their Analogues and ..., S. Coffey
Vidu ankaŭ[redakti | redakti fonton]
- Cianatoj
- Cianida acido
- Cianamido
- Kalcia cianamido
- Natria cianato
- Natria cianido
- Amonia cianato
- Amonia cianido
Referencoj[redakti | redakti fonton]
- ↑ Book Archive
- ↑ Van Nostrand’s Scientific Encyclopedia, Douglas M. Considine,Glenn D. Considine
- ↑ A Compendium of the Course of Chemical Instruction in the Medical, Robert Hare








![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)

