Maleata acido
| Maleata acido | ||

| ||
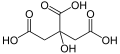
| Bastona kemia strukturo de la maleata acido | ||

| ||
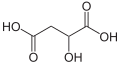
| Tridimensia kemia strukturo de la maleata acido | ||
| Alternativa(j) Nomo(j) | ||
| (Z-)-Butenodiojka acido Malenata acido Toksilata acido | ||
| Kemia formulo | HO2CCH=CHCO2H aŭ C4H4O4 | |
| PubChem-kodo | 444266 | |
| ChemSpider kodo | 392248 | |
| CAS-numero-kodo | 110-16-7 | |
| Karakterizaĵoj | ||
| Aspekto | blanka solidaĵo | |
| Acideco (pKa) | pka1= 1.92, pKa2 =6.27 | |
| Molmaso | 116.07216 g·mol-1 | |
| Smiles | O=C(O)\C=C/C(=O)O | |
| Denseco | 1.59 g/cm3 (20 °C) | |
| Fandopunkto | 135 °C (275 ℉; 408 K) (malkomponiĝa temperaturo) | |
| Akva solvebleco | 78 g/100 ml (25 °C) | |
| Sekurecaj Indikoj | ||
| Riskoj | R22 R36/37/38 | |
| Sekureco | S2 S26 S28 S37 | |
| Pridanĝeraj indikoj | ||
| Danĝero |
| |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H302, H315, H317, H319, H335[1] | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P270, P271, P272, P280, P301+312, P302+352, P304+340, P305+351+338, P312, P321, P330, P332+313, P333+313, P337+313, P362, P363, P403+233, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Maleata acido[2] aŭ cis-butenodiojka acido estas organika kombinaĵo klasifikata kiel dukarboksilata acido, kies molekulo posedas du karboksilajn grupojn. Ĝia kemia formulo estas HO2CCHCHCO2H. La maleata acido estas la cis-izomero de la butenodiojka acido, dum la fumarata acido estas la trans-izomero. Ĝi estas ĉefe uzata kiel antaŭmaterialo al la fumarata acido, kaj same kiel al ties parenco maleata anhidrido, la maleata acido havas malmultajn uzojn.

Fizikaj proprecoj[redakti | redakti fonton]
Maleata acido estas malpli stabila molekulo ol fumarata acido. La diferenco pri la Bruliva varmo estas 22.7 kJ·mol−1. La bruliva varmo estas -1355 kJ/molo. Maleata acido estas pli solvebla en akvo ol fumarata acido. La fandopunkto de la maleata acido (135 °C) estas same multe pli malalta ol fumarata acido (287 °C). Ambaŭ proprecoj de maleata acido povas eksplikiĝi pro la intramolekula hidrogena ligo okazanta en la maleata acido kaŭze de la intermolekula interagoj kiuj ne eblas en la fumarata acido por geometriaj kialoj.
Produktado kaj industriaj uzoj[redakti | redakti fonton]
Industrie, la maleata acido estiĝas per hidrolizo de la maleata anhidrido, kiu estas produktata per oksidigo de la benzeno[3] aŭ butano.
Maleata acido estas industria krudmaterialo por la produktado de glioksilata acido[4] per ozonolizo.
Maleata acido uzeblas por estigi acidajn aldonsalojn al drogoj por fari ilin pli stabilaj, tiel kiel indakaterola maleato[5].
Izomerigo al fumarata acido[redakti | redakti fonton]
La plej grava industria uzo de la maleata acido estas ties konvertiĝo al fumarata acido. Ĉi-konvertiĝo, iu izomerigo[6][7], estas katalizita per serio da reakciantoj, tiel kiel mineralaj acidoj kaj tioureo[8][9]. Same, la granda diferenco en akva solvebleco igas facila la purigadon de la fumaratan acidon.
La izomerigo estas populara temo en la lernejoj. Maleata acido kaj fumarata acidoj ne interkonvertiĝas spontanee ĉar la rotacio ĉirkaŭ la karbona-karbona duobla ligo[10] ne estas energie favora. Tamen, konvertiĝo de la cis izomero en trans-an izomeron eblas pere de fotolizo[11] en la ĉeesto da etaj kvantoj da bromo[12]. La lumo konvertas la elementa bromo en la radikalon broman, kiuj siavice atakas la alkenon per reakcio de radikaldono al la radikalo bromo-alkeno kaj nun eblas la unuopa rotacia ligo. La radikaloj bromaj rekombiniĝas kaj la fumarata acido formiĝas. Alia metodo, uzata en lecionĉambraj elmontradoj, la maleata acido transformiĝas en fumaratan acidon per iu varmigoprocezo de la maleata acido en solvaĵo kun klorida acido. Reversebla aldono de H+ kondukas al libera rotacio ĉirkaŭ la C-C[13] ligo kaj formado de pli stabila kaj malpli solvebla fumarata acido.
Aliaj reakcioj[redakti | redakti fonton]
Kvankam la komerca nepraktikebleco, la maleata acido estas konvertebla al maleata anhidrido per malhidratigo, al malika acido per hidratigo[14], kaj al sukcenata acido per hidrogenigo[15] (etanolo/paladio sur la karbono. Ĝi reakcias kun trionila klorido aŭ fosfora kvinklorido por estigi kloridon de la maleata acido (ne eblas izoli la kloridan unuacidon). Maleata acido, kiu estas elektrofila, partoprenas kiel dienofila[16] en multaj reakcioj Diels-Alder[17].
La maleata jono estas joniga formo de la maleata acido. La maleata jono utilas kiel inhibicianto en la transaminazaj reakcioj[18]. La esteroj de la maleata acido ankaŭ nomiĝas maleatoj, ekzemple la dimetila maleato[19].
Komponaĵoj[redakti | redakti fonton]
Vidu ankaŭ[redakti | redakti fonton]
Referencoj[redakti | redakti fonton]
- ↑ Pubchem
- ↑ Nova Plena Ilustrita Vortaro de Esperanto: maleata acido
- ↑ Chemical Processing Handbook, John J. McKetta Jr
- ↑ Foye's Principles of Medicinal Chemistry, Thomas L. Lemke, David A. Williams
- ↑ Indacaterol: The First Once-daily Long-acting Beta2 Agonist for COPD, Alexandre Trifilieff
- ↑ Organic Chemistry, Marye Anne Fox, James K. Whitesell
- ↑ Reactive Polymers Fundamentals and Applications: A Concise Guide to ..., Johannes Karl Fink
- ↑ Petrochemical Processes...., Alain Chauvel, Gilles Lefebvre
- ↑ Experimental Inorganic Chemistry, William George Palmer
- ↑ Organic Chemistry, William Brown, Christopher Foote, Brent Iverson, Eric Anslyn
- ↑ Free-radical Chemistry; Structure and Mechanism, D. C. Nonhebel, John Christopher Walton
- ↑ Handbook Of Chiral Chemicals, David John Ager
- ↑ Organic Chemistry, Thomas N. Sorrell
- ↑ Organic Chemistry, Marye Anne Fox, James K. Whitesell
- ↑ Quantum Chemistry: The Challenge of Transition Metals and Coordination Chemistry, A. Veillard
- ↑ Organic Chemistry, William Brown, Christopher Foote, Brent Iverson, Eric Anslyn
- ↑ The Diels-Alder Reaction: Selected Practical Methods, Francesco Fringuelli, Aldo Taticchi
- ↑ Scalable Green Chemistry: Case Studies from the Pharmaceutical Industry, Stefan Koenig
- ↑ Organic Chemistry, Jonathan Clayden, Nick Greeves, Stuart Warren