Nitrogena trifluorido
| Trifluoramino | |||||
 | |||||
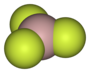
| Plata kemia strukturo de la Nitrogena trifluorido | |||||
 | |||||
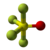
| Tridimensia kemia strukturo de la Trifluoramino | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 7783-54-2 | ||||
| ChemSpider kodo | 22959 | ||||
| PubChem-kodo | 24553 | ||||
| Merck Index | 15,6691 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | netoksa, koroda, senkolora forceja gaso kun malagrabla ŝima odoro | ||||
| Molmaso | 71,002 g·mol-1 | ||||
| Fandpunkto | -207°C | ||||
| Bolpunkto | -129°C | ||||
| Refrakta indico | 1,0004 | ||||
| Ekflama temperaturo | Nebrulema | ||||
| Solvebleco | Akvo:reakcias | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R14 R26/28 R35 R48/20 | ||||
| Sekureco | S7/8 S26 S36/37/39 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H270, H280, H332, H373 | ||||
| GHS Deklaroj pri antaŭgardoj | P220, P244, P260, P261, P271, P304+312, P304+340, P314, P370+376, P403, P410+403, P501[1] | ||||
(25 °C kaj 100 kPa) | |||||
Nitrogena trifluorido aŭ NF3 estas neorganika kombinaĵo de fluoro kaj nitrogeno, amoniaka derivaĵo kie tri hidrogenatomoj estis anstataŭitaj de fluoroatomoj, netoksa, koroda, senkolora forceja gaso kun malagrabla ŝima odoro, kiu povas prepariĝi per rekta interagado de la puraj elementoj sub elektra malŝarĝo.
En 1903, la germana kemiisto Otto Ruff (1871-1939) ĝin preparis per elektrolizo per fandita miksaĵo de amonia fluorido kaj fluorida acido. Eksperimente, ĝi montriĝis malpli reakciema ol aliaj nitrogenaj halogenidoj tiaj kiaj nitrogena triklorido, nitrogena tribromido kaj nitrogena trijodido, kiuj cetere estas eksplodemaj.
Trifluoramino ne estas irita per haŭtokontakto, tamen ĝi estas irita al pulmoj kvankam la tokseco estas malpli alta ol tiuj de nitrogenaj oksidoj. Troekspozicio per inhalado kaŭzas konvertadon de hemoglobino en la sango al metemoglobino.[2] La Nacia Instituto por Okupacia Sekureco kaj Sano (NIOSH) specifas ke la koncentriĝo pli danĝera al homa vivo au sano devas esti supera ol 1000 ppm.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
Sintezo 2[redakti | redakti fonton]
Sintezo 3[redakti | redakti fonton]
- Preparado per reakcio inter nitrozila fluorido kaj fluorida acido:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Malkomponado de nitrogena trifluorido:
Reakcio 2[redakti | redakti fonton]
- Hidrolizo de nitrogena trifluorido:
Reakcio 3[redakti | redakti fonton]
- Eksploda reakcio kun aluminia klorido:
Reakcio 4[redakti | redakti fonton]
- Oksidado de nitrogena trifluorido:
Reakcio 5[redakti | redakti fonton]
- Traktado de nitrogena trifluorido: kaj klorida acido
Reakcio 6[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido kaj sulfura trioksido:
Reakcio 7[redakti | redakti fonton]
- Preparado de tionila kvarfluorido:[3]
Reakcio 8[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido kaj sulfura trioksido:
Reakcio 9[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido sulfurila fluorido:
Reakcio 10[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido kaj sulfura trioksido:[3]
Reakcio 11[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido kaj sulfurila fluorido:
Reakcio 12[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido kaj sulfurila klorido:
Reakcio 13[redakti | redakti fonton]
- Preparado de "kvarfluoro hidrazino"
Reakcio 14[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido kaj antimona trifluorido
Reakcio 15[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido kaj antimona kvinfluorido
Reakcio 16[redakti | redakti fonton]
- Reakcio inter nitrogena trifluorido kaj tionila fluorido:
Vidu ankaŭ[redakti | redakti fonton]
Literaturo[redakti | redakti fonton]
- Fluorine: Compounds with Oxygen and Nitrogen
- Chemical Thermodynamics
- Houben-Weyl Methods of Organic Chemistry
- The Chemistry of the Non-Metals
- Flammability and Sensitivity of Materials in Oxygen-enriched Atmospheres
- Nature's Building Blocks









![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)