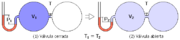Leĝo de Boyle: Malsamoj inter versioj
| [nekontrolita versio] | [nekontrolita versio] |
Enhavo forigita Enhavo aldonita
Neniu resumo de redakto |
e roboto aldono de: az:Boyl-Mariott qanunu |
||
| Linio 15: | Linio 15: | ||
[[ar:قانون بويل]] |
[[ar:قانون بويل]] |
||
[[ast:Llei de Boyle-Mariotte]] |
[[ast:Llei de Boyle-Mariotte]] |
||
[[az:Boyl-Mariott qanunu]] |
|||
[[be:Закон Бойля-Марыота]] |
[[be:Закон Бойля-Марыота]] |
||
[[bg:Закон на Бойл-Мариот]] |
[[bg:Закон на Бойл-Мариот]] |
||
| Linio 22: | Linio 23: | ||
[[cs:Boyleův-Mariottův zákon]] |
[[cs:Boyleův-Mariottův zákon]] |
||
[[da:Boyles lov]] |
[[da:Boyles lov]] |
||
[[de:Thermische Zustandsgleichung idealer Gase# |
[[de:Thermische Zustandsgleichung idealer Gase#Gesetz von Boyle-Mariotte]] |
||
[[el:Νόμος του Μπόιλ]] |
[[el:Νόμος του Μπόιλ]] |
||
[[en:Boyle's law]] |
[[en:Boyle's law]] |
||
| Linio 41: | Linio 42: | ||
[[ko:보일의 법칙]] |
[[ko:보일의 법칙]] |
||
[[ms:Hukum Boyle]] |
[[ms:Hukum Boyle]] |
||
[[nl:Algemene gaswet# |
[[nl:Algemene gaswet#Wet van Boyle]] |
||
[[nn:Boyle si lov]] |
[[nn:Boyle si lov]] |
||
[[no:Boyle-Mariottes lov]] |
[[no:Boyle-Mariottes lov]] |
||
Kiel registrite je 14:06, 16 okt. 2010
La leĝo de Boyle-Mariotte (aŭ leĝo de Boyle) diras, ke
Ekzemple, se la premo de unu gaso duobliĝas, la volumeno de la gaso reduktiĝos duone, kaj same inverse. La leĝon ektrovis en 1662 la irlanda fizikisto kaj ĥemiisto Robert Boyle.
Eksteraj ligiloj
greke http://www.thescubaguide.com/certification/boyles-law.aspx greke http://dbhs.wvusd.k12.ca.us/webdocs/GasLaw/Gas-Boyle-Data.html