Nitrila fluorido: Malsamoj inter versioj
| [kontrolita revizio] | [kontrolita revizio] |
DMacks (diskuto | kontribuoj) →Sintezo 3: better sizing |
DMacks (diskuto | kontribuoj) →Sintezo 11: fix chemical mistake |
||
| Linio 172: | Linio 172: | ||
{|cellspacing=10 cellpadding=10 border=5 |
{|cellspacing=10 cellpadding=10 border=5 |
||
| |
| |
||
[[Dosiero:Nitronium tetrafluoroborate3D.png|50px|nitronium tetrafluoroborate]]+[[Dosiero:Sodium fluoride.png|90px|natria fluorido]]<math>\mathsf{ \xrightarrow [\,]{}\, }</math>[[Dosiero:Nitryl-fluoride-3D-vdW.png|50px|nitrila fluorido]]+[[Dosiero:Sodium |
[[Dosiero:Nitronium tetrafluoroborate3D.png|50px|nitronium tetrafluoroborate]]+[[Dosiero:Sodium fluoride.png|90px|natria fluorido]]<math>\mathsf{ \xrightarrow [\,]{}\, }</math>[[Dosiero:Nitryl-fluoride-3D-vdW.png|50px|nitrila fluorido]]+[[Dosiero:Sodium-3D.png|30px|sodium]][[Dosiero:Tetrafluoroborate-ion-3D-balls.png|50px|tetrafluoroborate]] |
||
|- |
|- |
||
|} |
|} |
||
Kiel registrite je 11:52, 27 dec. 2019
| Nitrila fluorido | |||||
 | |||||
| Plata kemia strukturo de la Nitrila fluorido | |||||
 | |||||
| Tridimensia kemia strukturo de la Nitrila fluorido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 10022-50-1 | ||||
| ChemSpider kodo | 59588 | ||||
| PubChem-kodo | 66203 | ||||
| Merck Index | 15,6745 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora gaso kun fortaj oksidigaj potencaĵoj | ||||
| Molmaso | 65,003 g·mol-1
| ||||
| Fandpunkto | -166°C | ||||
| Bolpunkto | -72,6°C | ||||
| Mortiga dozo (LD50) | 60 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R14 R34 R37 R50 R45 R53 | ||||
| Sekureco | S26 S45 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa | ||||
| GHS Deklaroj pri damaĝoj | H220, H280, H314, H330, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P260, P264, P271, P273, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P363, P377, P381, P391, P403, P403+233, P405, P410+403, P501 | ||||
(25 °C kaj 100 kPa) | |||||
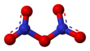
Nitrila fluorido aŭ NO2F estas neorganika nitrogena kombinaĵo de fluoro kaj oksigeno, senkolora gaso kun fortaj oksidigaj potencaĵoj kaj plej forta nitrogeniga agento kvankam la malfacilaĵoj por manipulado. Hetherington kaj Robinson raportis nitrogenigon de aromataĵoj per nitrila fluorido en malĉeesto de kataliziloj. Ili sugestis ke en akva solvaĵo, nitrila fluorido dissociiĝas en NO2+ katjonoj kaj F- jonoj kaj la nitrogeniuma peraĵo tiele formita estas la aktiva ingredienco en la nitrogenigoj.[1] Ĝenerale la reakcioj estiĝas en malaltaj temperaturoj.
Nitrila fluorido estas solvebla en pentano, karbona dusulfido, kloroformo kaj nitrobenzeno. Diversaj metaloj ekfajras en kontakto kun la gaso.[2] Nitrila fluorido estis unuafoje produktita en 1932 far Otto Ruff (1871-1939), Manzel[3] kaj Neumann[4] per agado de fluoro sur nitrogena duoksido. Tamen, en 1905, Henri Moissan (1852-1907) kaj Paul Lebeau (1868-1959) estis la unuaj kiuj priskribis reakcion inter fluora gaso kaj nitrogena duoksido.[5]
Sintezoj
Sintezo 1
- Sintezo per agado de nitrona fluoroborato sur natria fluorido:
Sintezo 2
- Preparado per traktado de dunitrogena kvinoksido kaj natria fluorido:[6]
Sintezo 3
- Preparado per interagado de dunitrogena kvinoksido, fluorida acido kaj bora trifluorido:
Sintezo 4
- Preparado per reakcio inter nitrogena duoksido kaj fluoro:
Sintezo 5
- Preparado per traktado de nitrila fluorido kaj kobalta (III) fluorido:
Sintezo 6
- Sintezo per traktado de nitrogena duoksido kaj oksigena dufluorido:
Sintezo 7
- Preparado per traktado de nitrozila fluorido kaj ozono:
Sintezo 8
- Metodo de Schmeisser kaj Elischer:Preparado per agado de arĝenta (I) fluorido sur nitrila klorido:[6]
Sintezo 9
- En 1905, Moissan kaj Lebeau preparis nitrobenzenon per interagado de nitrokarbonilo kaj fluorgaso:[7]
Sintezo 10
- Sintezo per traktado de fosfora kvinfluorido kaj nitrogena duoksido:
Sintezo 11
- Per interagado de nitrogeniuma kvarfluoroborato kaj natria fluorido:
Reakcioj
Reakcio 1
- Preparado de nitrata acido per hidrolizo de nitrila fluorido:
Reakcio 2
- Preparado de natria nitrato kaj natria fluorido per interagado de nitrila fluorido sur natria hidroksido:
Reakcio 3
- Sintezo de silicia kvarfluorido ekde la nitrila fluorido:
|
4 |
Reakcio 4
- Sintezo de nitrozil fluorido ekde nitrila fluorido kaj kemia elemento fero:
Reakcio 8
- Nitrigo de akloholoj per interagado de nitrila fluorido sur metanolo:
Reakcio 9
- Sintezo de nitro-benzeno per interagado de nitrila fluorido kaj benzeno en ĉeesto de aluminia trifluorido:
Literaturo
- Chemistry of Energetic Materials
- Aromatic Nitration
- The Chemistry of Nonaqueous Solvents VB: Acid and Aprotic Solvents
- The Chemistry of the Non-Metals
- The Chemistry of Nitrogen: Pergamon Texts in Inorganic Chemistry
- Abstracts of Doctors' Dissertations







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)
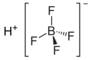





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{AlF_{3}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1abd2a95952f30b066405153f8896a63a485f92)
