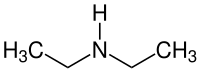
Duetilamino
| Duetilamino | |||||
 | |||||
| Plata kemia strukturo de la Duetilamino | |||||
 | |||||
| Tridimensia kemia strukturo de la Duetilamino | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 109-89-7 | ||||
| ChemSpider kodo | 7730 | ||||
| PubChem-kodo | 8021 | ||||
| Merck Index | 15,3122 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora brulema koroda likvaĵo kun fiŝodoro | ||||
| Molmaso | 73139 g·mol−1 | ||||
| Denseco | 0.7074g cm−3 | ||||
| Fandpunkto | −49.8 °C | ||||
| Bolpunkto | 54.8 °C | ||||
| Refrakta indico | 1,3864 | ||||
| Ekflama temperaturo | −23 °C | ||||
| Memsparka temperaturo | 290 °C | ||||
| Acideco (pKa) | 11.02 | ||||
| Solvebleco | Akvo:Tute solvebla | ||||
| Mortiga dozo (LD50) | 540 mg/kg (buŝe) | ||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝo | ||||
| GHS Deklaroj pri damaĝoj | H225, H301, H301+311+331, H302, H311, H312, H314, H318, H331, H332, H335[1] | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P280, P301+310, P301+312, P301+330+331, P302+352, P303+361+353, P304+312, P304+340, P305+351+338, P310, P311, P312, P321, P330, P361, P363, P370+378, P403+233, P403+235 | ||||
(25 °C kaj 100 kPa) | |||||
Duetilamino estas estas sekundara organika amino kie du etilaj grupoj (-CH2-CH3) anstataŭas du hidrogenatomojn en la amina grupo (NH2). Ĝi estas senkolora brulema koroda likvaĵo kun fiŝodoro, miksebla kun akvo, etanolo, kloroformo, etero kaj karbona tetraklorido.
Ĝi estas irita kaj toksa substanco, koroda al okuloj kaj haŭto. Ĝiaj vaporoj estas pli densaj ol aero kaj dum brulado ĝi eligas toksajn nitrogenajn oksidojn. Duetilamino uzatas kiel korodo-inhibanto. Ĝi same uzatas en la produktado de kaŭĉuko, rezinoj, farboj kaj farmaciaĵoj.
Ĝi estas deirmaterialo por la produktado de la duetilamido de la lizergata acido. Duetilamino estas malforte toksa sed ĝiaj vaporoj kaŭzas efemerajn vidado-perturbojn.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
Sintezo 2[redakti | redakti fonton]
- Duetilamino estas preparebla per interagado de la etilamino kaj etanolo
Sintezo 3[redakti | redakti fonton]
- Trietilamino estas preparebla per interagado de la duetilamino kaj etanolo
Sintezo 4[redakti | redakti fonton]
- Etilamino estas preparebla per kataliza interagado de la etila jodido kaj amoniako
Reakcio 5[redakti | redakti fonton]
- Preparado de duetilamino per hidrolizo de la duetiltrifluoroacetamido:[2]
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Duetilamino reakcias kun klorida acido por doni duetilaminan kloridon:
Reakcio 2[redakti | redakti fonton]
- Duetilamino reakcias kun acetata acido por doni duetilaminan acetaton:
Reakcio 3[redakti | redakti fonton]
- Duetilamino reakcias kun nitroza acido donante nitrozan duetilaminon kaj akvon.
Reakcio 5[redakti | redakti fonton]
- Duetilamino reakcias kun karbona dusulfido en alkala medio donante duetil-dutiokarbamatojn:
Reakcio 6[redakti | redakti fonton]
- Duetilamino reakcias kun butil-litio donante litian duetilaminon kaj butanon:
Literaturo[redakti | redakti fonton]
- Merck Millipore
- Chemical Book
- Fisher Scientific
- Sigma Aldrich
- Cameo Chemicals
- Handbook on Biodegradation and Biological Treatment of Hazardous Organic ..., M.H. van Agteren, Sytze Keuning, Jan Oosterhaven
- Handbook of Environmental Fate and Exposure Data For Organic Chemicals, Volume 2, Philip H. Howard






![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)