Sulfura heksafluorido
| Sulfura heksafluorido | |||
 | |||
| Plata kemia strukturo de la Sulfura heksafluorido | |||
 | |||
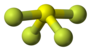
| Tridimensia kemia strukturo de la Sulfura heksafluorido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 2551-62-4 | ||
| ChemSpider kodo | 16425 | ||
| PubChem-kodo | 17358 | ||
| Merck Index | 15,9103 | ||
| Fizikaj proprecoj | |||
| Aspekto | senodora, senodora, nebrulema, netoksa, inerta gaso kun oktoedra molekula strukturo | ||
| Molmaso | 146,05 g·mol-1 | ||
| Denseco | 1,225g cm−3 | ||
| Fandpunkto | -63,8°C | ||
| Bolpunkto | -50,8°C (sublimiĝas) | ||
| Ekflama temperaturo | nebrulema | ||
| Solvebleco | Akvo:6,164 g/L | ||
| Mortiga dozo (LD50) | 5790 mg/kg (buŝe)[1] | ||
| Sekurecaj Indikoj | |||
| Riskoj | R5 R21 R37 [2] | ||
| Sekureco | S9 S33 S38 S41 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H280, H336 | ||
| GHS Deklaroj pri antaŭgardoj | P261, P271, P304+340, P403+233, P405, P410+403, P501[3] | ||
(25 °C kaj 100 kPa) | |||
Sulfura heksafluorido aŭ SF6 estas neorganika fluora kombinaĵo de sulfuro, senodora, nebrulema, netoksa, inerta gaso kun oktoedra molekula strukturo, kvinoble pli densa ol aero, malmulte solvebla en akvo sed solvebla en nepolaraj organikaj solvantoj. Ĝia molekulo prezentas ses fluoratmojn ligitajn al centra sulfuratomo. Ĝi estas kvinvalenta molekulo kaj nepolara gaso.
Estante kvinoble pli densa ol aero, tio signifas ke ĝiaj molekuloj plenigas determinitan spacon kun plejmulto el aliaj gasoj. Se vi liberigas balonon plenan de sulfura heksafluorido (molekulla maso egala al 146) kaj balonon plenan de heliumo (molekula maso egala al 4) en la aeron (molekula maso 29), la heliuma balono supreniras en la plafonon kaj tiu plenigitan per sulfura heksafluorido iras plankodirekten.[4]
Ĝi estas unu el la plej stabilaj gaskemiaĵoj kaj ĝia inerteco similas al tiu de la nitrogena gaso. Kun bonega izola kaj arko-rompa kapableco, sulfura heksafluorido estas vaste uzata en la kampoj pri elektronikaĵoj, medicinaĵoj, lazeraĵoj, frostigaĵoj, fajro-forviŝaĵoj, kemiaĵoj, militaragado, spaca aviadado, ne-fera metalurgio kaj fizikaj esploroj.
Iom da historio[redakti | redakti fonton]
La industria produktado de SF6 komencis en 1953, en Usono, stimulita de la merkato-enkonduko je elektraj cirkvitrompiloj kun izolagaso. Ĝia enkonduko permesis anstataŭigon de mineralaj oleoj kaj la uzon de pli kompakta elektra aparataro, ĉefe en urbaj areoj.
Ĉirkaŭ la sama epoko, esploroj rilate al SF6 komencis en la iama Sovetunio. De tiu periodo ĝis la hodiaŭaj tagoj, produktado de SF6 konstante kreskis kun la rapido de ĉi-kreskado pliigante en la unuaj jaroj de la jardeko 1970, kiu estis periodo da vasta enkondukado de alta-tensiaj gas-izolitaj cirkvitrompiloj kaj aliaj elektraj ekipaĵoj.[5]
SF6 estas alte potenca vivmedia poluaĵo. Ĝi havas globa varmigo 23.900 fojojn pli alta ol tiu de CO2 kaj atmosfera vivolongo je 3.200 jaroj. SF6 estas solvebla en alkoholo, heksano kaj benzeno.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Sulfura heksafluorido estis unue produktita en 1891 de francaj kemiistoj Henri Moissan (1852-1907) kaj Paul Lebeau (1868-1959). En 1900 ili preparis la densan gason per brulado de sulfuro kaj fluoro. Kvankam sulfura heksafluorido estas preparebla per aliaj manieroj, inklude per brulado de la bazaj elementoj, kaj elektrolizo de sulfidoj, ekzemple hidrogena sulfido en likva hidrogena fluorido, la originala metodo je preparado ankoraŭ estas preferebla.[6]
Sintezo 2[redakti | redakti fonton]
- Preparado per traktado de fluorida acido sur sulfuro:
Sintezo 3[redakti | redakti fonton]
- Preparado per traktado de sulfida acido sur fluoro:
Sintezo 4[redakti | redakti fonton]
- Preparado per interagado de natria fluorido, tionila fluorido kaj akvo donante kiel subproduktojn natrian kloridon, sulfuran duoksidon kaj hidrogenan sulfidon:
Sintezo 5[redakti | redakti fonton]
- Heksafluorido de sulfuro estas produktata per malkomponado de dusulfura dekafluorido:
Sintezo 6[redakti | redakti fonton]
- Kobalta (III) fluorido reakcias kun sulfura kvarfluorido por formi sulfuran heksafluoridon kaj kobalta (III) fluorido:
Sintezo 7[redakti | redakti fonton]
- Interagado de sulfura duoksido kaj fluoro:[7]
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Sulfura heksafluorido reakcias kun akvo por formi sulfitan acidon, fluoridan acidon kaj sulfidan acidon:
Reakcio 2[redakti | redakti fonton]
- Sulfura heksafluorido reakcias kun elementa natrio donante natrian sulfiton kaj natrian fluoridon:[8]
Reakcio 3[redakti | redakti fonton]
- Sulfura heksafluorido reakcias kun sulfidan acidon por formi sulfuron kaj fluoridan acidon:
Reakcio 4[redakti | redakti fonton]
- Sulfura heksafluorido reakcias kun jodida acido por formi fluoridan acidon, sulfidan acidon kaj jodon:
Reakcio 5[redakti | redakti fonton]
- Sulfura heksafluorido reakcias kun fosforila fluorido por doni fosforan kvinfluoridon kaj sulfuran kvarfluoridon
Literaturo[redakti | redakti fonton]
- Drugbank
- Chemical Book
- Physics Demonstrations: A Sourcebook for Teachers of Physics
- Mitigating Greenhouse Gas Emissions: Voluntary Reporting
- Patty's Toxicology
- Toxicology of the eye
- Toxnet
Referencoj[redakti | redakti fonton]
- ↑ Hynote Gas
- ↑ Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens
- ↑ PubChem
- ↑ How stuff works
- ↑ Gas World. Arkivita el la originalo je 2018-12-04. Alirita 2018-12-03.
- ↑ Advances in Inorganic Chemistry and Radiochemistry
- ↑ Merck Index 15-a Eldono
- ↑ Inorganic Chemistry





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{300^{o}C-400^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c1b2d01c21959b67e2f4ee1cec7bd55bf03f47d)


![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{881,3^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea3a5121ef80e8ae6a4ef3a5293936e6f6579874)

