t-Butila acetato
| t-Butila acetato | |||
 | |||
| Plata kemia strukturo de la t-Butila acetato | |||
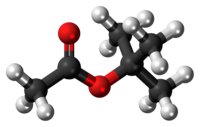 | |||
| Tridimensia kemia strukturo de la t-Butila acetato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 540-88-5 | ||
| ChemSpider kodo | 10446 | ||
| PubChem-kodo | 10908 | ||
| Merck Index | 15,1539 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora likvaĵo kun fruktodoro | ||
| Molmaso | 116,16 g·mol−1 | ||
| Denseco | 0,866g cm−3[1] | ||
| Fandpunkto | −62 °C[2] | ||
| Bolpunkto | 97,8 °C | ||
| Refrakta indico | 1,3855[3] | ||
| Ekflama temperaturo | 16,7 °C | ||
| Memsparka temperaturo | 435 °C | ||
| Solvebleco | Akvo:0,83 g/L | ||
| Mortiga dozo (LD50) | 4100 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R11 R66 | ||
| Sekureco | S16 S23 S25 S29 S33 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H225, H332 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P261, P271, P280, P303+361+353, P304+312, P304+340, P370+378, P403+235, P501][4] | ||
(25 °C kaj 100 kPa) | |||
t-Butila acetato aŭ C6H12O2 estas kemia kombinaĵo, apartenanta al la funkcia grupo de la esteroj de la acetata acido kaj t-butanolo, senkolora likvaĵo kun fruktodoro, uzata kiel solvanto kaj kiel gustiga kaj odorigagento. Kutime ĝi estiĝas per kondensiĝa reakcio aŭ per esterigo de Fischer-Speyer kun sulfata acido kiel katalizilo. t-Butila acetato estas malmulte solvebla en akvo, sed estas pli solvebla en alkoholo, duetila etero, kloroformo kaj plejmulto el la organikaj solvantoj.
t-Butila acetato ankaŭ uzatas kiel solvanto por farboj. Ĝi reakcias kun acidoj kaj alkoholoj liberigante grandan kvanton da energio kaj varmo. Fortaj oksidigaj acidoj povas kaŭzi eksplodan reakcion sufiĉe alta por ekbruli la produktojn de la reakcio. Granda amaso da varmo ankaŭ liberiĝas per interagado de la estero kun kaŭstikaj solvaĵoj. Kun alkalaj metaloj kaj alkalaj metaloj ĝi generas bruleman hidrogenon.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per traktado de acetata acido kaj t-butanolo:
Sintezo 2[redakti | redakti fonton]
- Preparado per traktado de acetata anhidrido kaj t-butanolo:
Sintezo 3[redakti | redakti fonton]
- Preparado per traktado de terc-butila klorido kaj acetata acido:
Sintezo 4[redakti | redakti fonton]
- Preparado per interagado de natria acetato kaj terc-butila klorido:
Sintezo 5[redakti | redakti fonton]
- Reakcio de transesterigo inter t-butila formiato kaj metila acetato:
Sintezo 6[redakti | redakti fonton]
- Per transigo de la t-butila radikalo inter t-butila benzoato kaj acetata acido:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Hidrolizo de la t-butila acetato:
Reakcio 2[redakti | redakti fonton]
- Sapigo de la t-butila acetato:
Reakcio 3[redakti | redakti fonton]
- Reduktigo de la t-butila acetato:
Reakcio 4[redakti | redakti fonton]
- Per transesteriga reakcio inter benzoata acido:
Reakcio 5[redakti | redakti fonton]
- Reakcio kun klorida acido:
Reakcio 6[redakti | redakti fonton]
- Reakcio kun amoniako:
Literaturo[redakti | redakti fonton]
- Chemicalland21
- The Good Scents Company
- PCI Paint&Coatings Industry
- InChem
- Groundwater Chemicals Desk Reference
- Handbook of Environmental Fate and Exposure Data for Organic Chemicals
- Butyl Acetates







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)


![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3e0bf23d773dd68c0756bf7219ac82b7a51e73c6)
