Tanĝeritino
| Tanĝeritino | |||
 | |||
| Plata kemia strukturo de la Tanĝeritino | |||
 | |||
| Tridimensia kemia strukturo de la Tanĝeritino | |||
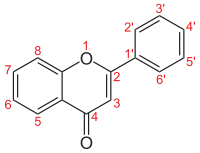 | |||
| Numerigo de la karbonaj strukturoj de la flavonoj. | |||
 | |||
| Tanĝeritino estas medicina substanco kun antikarcinomogenaj proprecoj trovata en plantoj de la familio de la Citrus reticulata[1] | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 481-53-8 | ||
| ChemSpider kodo | 61389 | ||
| PubChem-kodo | 68077 | ||
| Fizikaj proprecoj | |||
| Aspekto | kristalblanka solidaĵo | ||
| Molmaso | 372,369 g·mol-1 | ||
| Denseco | 1,244g cm−3[2] | ||
| Fandpunkto | 153°C-157°C[3] | ||
| Bolpunkto | 565,3°C[4] | ||
| Refrakta indico | 1,565 | ||
| Ekflama temperaturo | 248,4 °C[5] | ||
| Solvebleco | Akvo:0,0087 g/L [6] | ||
| Mortiga dozo (LD50) | 998 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R25 R36/37/38 | ||
| Sekureco | S26 S36 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H300 | ||
| GHS Deklaroj pri antaŭgardoj | P264, P270, P301+310, P321, P330, P405, P501[7] | ||
(25 °C kaj 100 kPa) | |||
Tanĝeritino, "tanĝeretino", aŭ C20H20O7 estas kvinmetoksila flavono, kun metoksilaj grupoj en la pozicioj 4', 5, 6, 7 kaj 8 de la kromenonila grupo. Tanĝeritino ĉeestas en la ŝeloj de la pomo, tanĝerino kaj aliaj citrusaj fruktoj. Cetere, tiuj fruktoj karakteriziĝas per akumulado de altaj kvantoj da flavanonaj glukozidoj tiaj kiaj naringino, "tanĝeritino" kaj "nobiletino". Tanĝeritino plifortigas la ĉelmurojn kaj agas kiel mekanismo por plantodefendo kontraŭ patogenaĵojn kiuj kaŭzas malsanojn.
Lastatempaj raportoj elmontris la efikajn rezultojn en la traktado kontraŭ la Parkinsona malsano. Ĉi-flavono plialtigis ĝiajn promesojn en la batalado kontraŭ la kolesterolo, kancero kaj eĉ en la protektado de la cerboĉeloj kontraŭ neŭraj malsanoj. Ĝiaj potencialoj kontraŭ kanceraj tumoroj estis elmontritaj en la traktado de leŭkemio sen detruado de la sanĉeloj. En aliaj eksperimentoj, tanĝeretino plialtigis la nivelojn da cerbohormonon dopaminon kaj rivelis cerboprotektivan aktivecojn.[8]
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado ekde la akacetino per interŝanĝo de du hidroksilaj grupoj je metoksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo kaj aldono de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo:
Sintezo 2[redakti | redakti fonton]
- Preparado ekde la apigenino per interŝanĝo de du hidroksilaj grupoj je metoksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, aldono de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo kaj anstataŭado de hidroksila grupo je metoksila grupo en la 4'-a pozicio de la fenila grupo:
Sintezo 3[redakti | redakti fonton]
- Preparado ekde la krizino per interŝanĝo de du hidroksilaj grupoj je metoksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, aldono de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo kaj aldono de metoksila grupo en la 4'-a pozicio de la fenila grupo:
Sintezo 4[redakti | redakti fonton]
- Preparado ekde la luteolino per interŝanĝo de du hidroksilaj grupoj je metoksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, aldono de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo, anstataŭado de hidroksila grupo je metoksila grupo en la 4'-a pozicio de la fenila grupo kaj aldono de hidroksila grupo en la 5-a pozicio de la fenila grupo:
Sintezo 5[redakti | redakti fonton]
- Preparado ekde la miriketino per interŝanĝo de du hidroksilaj grupoj je metoksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, aldono de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo, anstataŭado de hidroksila grupo je metoksila grupo en la 4'-a pozicio de la fenila grupo kaj aldono de du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila grupo:
Sintezo 6[redakti | redakti fonton]
- Preparado ekde la kverketino per interŝanĝo de du hidroksilaj grupoj je metoksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, aldono de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo, anstataŭado de hidroksila grupo je metoksila grupo en la 4'-a pozicio de la fenila grupo kaj forigo de hidroksila grupo en la 5-a pozicio de la fenila grupo:
Sintezo 7[redakti | redakti fonton]
- Preparado ekde la naringenino per interŝanĝo de du hidroksilaj grupoj je metoksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, aldono de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo, anstataŭado de hidroksila grupo je metoksila grupo en la 4'-a pozicio de la fenila grupo:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Konvertado al akacetino per interŝanĝo de du metoksilaj grupoj je hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo kaj forigo de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo:
Reakcio 2[redakti | redakti fonton]
- Konvertado al apigenino per interŝanĝo de du metoksilaj grupoj je hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, forigo de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo kaj anstataŭado de metksila grupo je hidroksila grupo en la 4'-a pozicio de la fenila grupo:
Reakcio 3[redakti | redakti fonton]
- Konvertado al krizino per interŝanĝo de du metoksilaj grupoj je hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, forigo de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo kaj forigo de metoksila grupo en la 4'-a pozicio de la fenila grupo:
Reakcio 4[redakti | redakti fonton]
- Konvertado al luteolino per interŝanĝo de du metoksilaj grupoj je hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, forigo de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo, anstataŭado de metoksila grupo je hidroksila grupo en la 4'-a pozicio de la fenila grupo kaj forigo de hidroksila grupo en la 5-a pozicio de la fenila grupo:
Reakcio 5[redakti | redakti fonton]
- Konvertado al miriketino per interŝanĝo de du metoksilaj grupoj je hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, forigo de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo, anstataŭado de metoksila grupo je hidroksila grupo en la 4'-a pozicio de la fenila grupo kaj forigo de du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila grupo:
Reakcio 6[redakti | redakti fonton]
- Konvertado al kverketino per interŝanĝo de du metoksilaj grupoj je hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, forigo de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo, anstataŭado de metoksila grupo je hidroksila grupo en la 4'-a pozicio de la fenila grupo kaj aldono de hidroksila grupo en la 5-a pozicio de la fenila grupo:
Reakcio 7[redakti | redakti fonton]
- Konvertado al naringenino per interŝanĝo de du metoksilaj grupoj je hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, forigo de du metoksilaj grupoj en la 6-a kaj 8-a pozicioj de la kromenonila grupo, anstataŭado de metoksila grupo je hidroksila grupo en la 4'-a pozicio de la fenila grupo:
Literaturo[redakti | redakti fonton]
- Frutas Que Encantam E Curam
- New Polymers for Encapsulation of Nutraceutical Compounds
- Natural Substances for Cancer Prevention
- Komplementäre Onkologie: supportive Maßnahmen und evidenzbasierte Empfehlungen
- Phytochemicals in Health and Disease
- Dictionary of Nutraceuticals and Functional Foods
- Flavonoids in the Living System
- Flavonoids in Cell Function






![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)