Valentelektrono
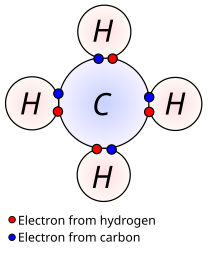
En kemio, valentelektrono[1] estas elektrono de la ekstera elektronkovraĵo de atomo.[2]:92, §6.1 Se tiu ekstera elektronkovraĵo ne estas plena, do la valentelektronoj povas partopreni en la kreado de kemia ligo inter atomoj.
Difino[redakti | redakti fonton]
Valentelektrono de ĉefgrupa elemento[redakti | redakti fonton]
Por ĉefgrupa elemento, valentelektrono estas elektrono en la elektronkovraĵo de la plej granda ĉefkvantumnombro ; tial, la nombro de valentelektronoj en ĉefgrupelementa atomo estas inter 1 kaj 8.
Ekzemple, jen la elektronkovraĵoj de fosforo:
- 1s2 2s2 2p6 3s2 3p3
Inter tiuj elektronkovraĵoj, la plej alta ĉefkvantumnombro estas , kaj la kvin valentelektronoj estas tiuj en la elektronkovraĵoj 3s2 kaj 3p3. Tial, ekzemple, fosforo povas formi la molekulon PF5 (fosfora pentafluorido).
Valentelektrono de transirmetalo[redakti | redakti fonton]
En transirmetalo ekzistas parte plenaj energiniveloj , kies elektronoj havas energiojn similajn al tiuj en la elektronkovraĵo de la plej granda ĉefkvantumnombro. Tial, por tiuj elementoj, valentelektrono estas ajna elektrono ekster la noblagasa kerno.
Ekzemple, jen la elektronoj de mangano:
- 1s2 2s2 2p6 3s2 3p6 4s2 3d5 = [Ar] 4s2 3d5,
en kiu [Ar] estas mallongigo de la elektronkovraĵoj de argono:
- [Ar] = 1s2 2s2 2p6 3s2 3p6.
Tial, en mangano, la sep valentelektronoj estas tiuj en 4s2 kaj 3d5.
Propraĵoj[redakti | redakti fonton]
La nombro de valentelektronoj determinas la reakciemon de elemento. Elemento, kies valentelektronoj kompletigas elektronkovraĵon (t.e. nobla gaso), estas tute ne reakciema. Male, elemento, kiu havas valentelektronojn po unu por atomo (t.e. alkala metalo), estas tre reakciema.
Referencoj[redakti | redakti fonton]
- ↑ Duc Goninaz, Michel; Klaŭdo Roux. (2020) “Valent/elektron/o”, Plena Ilustrita Vortaro de Esperanto 2020 (esperante).
- ↑ Stoker, H. S.; M. R. Slabaugh. Ĝenerala, Organika, Kaj Biologia Kemio (esperante).



