Galvana pilo

La galvana pilo aŭ ĉelo estas fonto de elektromova forto, taŭga por senpere transformi la kemian energion de difinita reago en elektran energion. Ĝi estas uzata en baterioj kaj akumulatoroj. Ĉiu kombinaĵo de du diversaj elektrodoj kaj elektrolitoj signifas galvanan pilon.
La funkciado de la galvana pilo baziĝas sur redoksa reakcio. La redukcio okazas separate de la oksidado en duonpilo (duonĉelo). Per la kunligo de la du duonpiloj per elektra kondukilo kaj jonkondukilo, la elektra cirklo fermiĝas. La tensio de la galvana pilo dependas de la uzataj metaloj kaj la koncentritecoj de la solvaĵoj. Male al elektrolita pilo, oni povas elgajni energion en la galvana pilo, dum la elektrolizo bezonas energion. La anodo estas ŝargita en galvana pilo negative, la katodo pozitive.
La nomo devenas el la nomo de la itala kuracisto Luigi Galvani.
Ekzemploj
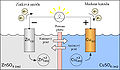
[redakti | redakti fonton]Kupra elektrodo en kupra sulfata solvaĵo kaj zinka elektrodo en zinka sulfata solvaĵo, kunligitaj per drato (elektronkondukta) kaj kun tensiometro kaj jonkonduktilo.
Ĉe la zinka elektrodo iras pli da Zn2+-jonoj en la solvaĵon ol Zn-jonoj eliĝas. Tiel la zinko fordonas elektronojn al la elektrodo, se ĝi iras en la solvaĵon, la elektrodo ŝargiĝas negative.
Male okazas ĉe la kupra elektrodo, kie eliĝas pli da Cu2+-jonoj ĉe la elektrodo ol kiom eniras la solvaĵon. Ĉar la Cu2+-jonoj por la eliĝo bezonas du elektronojn, estiĝas sur la kuproelektroda elektrona manko, ĝi ŝargiĝas pozitive.
Se la du elektrodoj estas kunligitaj per elektra konduktilo, tiel estiĝas tensio sed kurento ankoraŭ ne fluas. La kaŭzo estas, ke en la zinka solvaĵo estiĝas plimulto el Zn2+-jonoj kaj ĝi iĝas pozitive ŝargita. Tiel eniras multaj zinkjonoj la solvaĵon, kiuj samtempe eliĝas ĉe la elektrodo. Simila okazas ĉe la kupra solvaĵo, nur la solvaĵo estas negative ŝargita tie.
Kupra solvaĵo: c[SO2-
4] >> c[Cu2+]
Zinksulfata solvaĵo: c[SO2-
4] << c[Zn2+]
Pro tio oni devas kunligi la solvaĵojn per jona ponto. Tiel povas la Zn2+ jonoj migri en la kupran solvaĵon kaj la SO2-
4-jonoj en la zinkan solvaĵon. Estiĝas ŝargoegaliĝo kaj ekfluas la kurento inter la du solvaĵoj. Specife tiu galvana pilo nomiĝas Daniell-pilo.
Ekzistas ankaŭ galvanaj piloj kun du samaj duonpiloj, kiuj diferenciĝas je la koncentriteco. Tiu ĉi nomiĝas konzentreca pilo.