Ĉaperono
En biologio, ĉaperonoj estas aro de proteinoj troveblaj en ĉiuj ĉeloj, kies ĉefa funkcio rilatas al faldebligo de proteinoj tuj post ilia sintezo. Ili plenigas ilian funkcion ekzemple per evitado de nekorektaj asocioj inter proteinoj. Kutime ili havas trueton, kiun devas eniri nefalditaj proteinoj por esti traktitaj.
Ĉaperonoj estas troveblaj en preskaŭ ĉiuj specioj, kaj ili estas tre konservitaj, pro tio ke ili estas esencaj por la ebligo de multaj aliaj proteinoj.
La proteinoj de tiu ĉi grupo ankaŭ helpas aliajn proteinojn pri ĉel-transportado.
Historio
[redakti | redakti fonton]La vorto ĉaperono (el la angla chaperon, viro, kies tasko estas kontroli, kutime laŭ peto de gepatroj, unu aŭ pli junulojn dum sociaj eventoj, por inspekti ilian agadon kaj eviti neadekvatan konduton) estis ekuzita en molekula biologio de Ron Laskey en 1978, rilate al molekulaj ĉaperonoj, por priskribi ĉelkernajn proteinojn, kiuj evitis kuniĝo de falditaj histonoj kaj DNA dum konstruado de nukleosomoj. Poste, dum la 80-aj jaroj, tiu ĉi vorto estis reuzita pli ĝenerale rilate al diversaj eŭkariotaj kaj prokariotaj protein-familioj, kun similaj funkcioj.
Ekzemploj
[redakti | redakti fonton]Ekzistas diversaj familioj de ĉaperonoj, kiuj helpas proteinfaldadon diversmaniere. Multaj ĉaperonoj, sed ne ĉiuj, estas ankaŭ varm-ŝokaj proteinoj; por ili, la prefikso Hsp (el la angla heat shock protein) estas uzita, kutime sekvita de numero, kiu indikas la mason de la proteino en kDa.
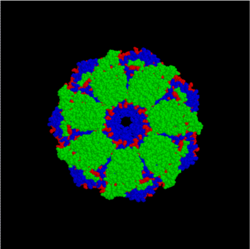
- Hsp60 (GroEL/GroES proteinaro ĉe Escherichia coli), eŭkariota proteinfamilio, kiu helpas faldadon de kloroplastaj aŭ mitokondriaj proteinoj. Ili estas faritaj de du unuiĝintaj ringoj, kun truo en la centro, kies grandeco estas proksimume 50 Å, kie estas traktitaj la faldotaj proteinoj.
- Hsp70 (DnaK ĉe Escherichia coli),
- Hsp90 (HtpG Escherichia coli), en ilia N-terminala ekstremumo ili havas liglokon al ATP, kiu utilas por diversaj funkcioj.
- Hsp100, proteinfamilio tre konservita kaj trovita en pluraj specioj.
