Acetilacetono
| Acetilacetono | |||
 | |||
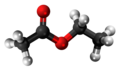
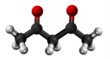
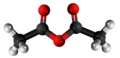
| Plata kemia strukturo de la Acetilacetono | |||
 | |||
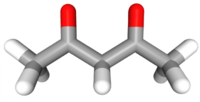
| Tridimensia kemia strukturo de la Acetilacetono | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 123-54-6 | ||
| ChemSpider kodo | 29001 | ||
| PubChem-kodo | 31261 | ||
| Merck Index | 15,76 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora aŭ verde flava, brulema likvaĵo kun agrabla odoro | ||
| Molmaso | 100,117 g·mol-1 | ||
| Denseco | 0,975g cm−3[1] | ||
| Fandpunkto | -23°C[2] | ||
| Bolpunkto | 138°C | ||
| Refrakta indico | 1,4494 | ||
| Ekflama temperaturo | 34 °C | ||
| Memsparka temperaturo | 340 °C[3] | ||
| Solvebleco | Akvo:160 g/L | ||
| Mortiga dozo (LD50) | 575 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R11 R36/37/38 R10 R22 R20/21/22 | ||
| Sekureco | S21 S23 S24/25 S36 S26 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H226, H302, H311, H320, H331, H335, H341, H370, H402, H412 | ||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273, P280, P281, P301+312, P302+352, P303+361+353, P304+340, P305+351+338, P308+313, P311, P321, P330, P337+313, P361, P363, P370+378, P403+233[4] | ||
(25 °C kaj 100 kPa) | |||
Acetilacetono aŭ C5H8O2 estas organika kombinaĵo, apartenanta al la familio de la duketonoj, senkolora aŭ verde flava, brulema likvaĵo kun agrabla odoro, kiu ekzistas en taŭtomera ekvilibro. La taŭtomeroj plej ofte interkonvertiĝas tiel rapide ke ili agas kiel unika komponaĵo en la plejmulto el la aplikoj. Ĝi estas antaŭaĵo de la acetilacetonata jono kaj konstrubloko por konstruado de sennombraj heterociklaj kombinaĵoj.
Taŭtomerio[redakti | redakti fonton]

La ketona kaj enolaj taŭtomeroj de la acetilacetono kunekzistas en solvaĵo, signifante ke la hidrogenatomo estas dividata inter la du oksigenatomoj. La ekvilibra konstanto en la gasfazo estas 11,7, kun iom da devio al la enola formo. La taŭtomeraj formoj estas distingitaj pere de Spektroskopio per nukleomagneta resonanco[5] kaj infraruĝa spektroskopio[6], krom aliaj metodoj.
La ekvilibra konstanto laŭŝajne montriĝas pli forta en nepolaraj solvantoj, la ketona formo estas pli favora en polaraj solvantoj, hidrogen-ligadaj solvantoj, tia kia la akvo. La enola formo estas vinil-simila analogaĵo de iu karboksilata acido.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per traktado de acetono kaj acetata anhidrido en ĉeesto de bora trifluorido: [7]
Sintezo 2[redakti | redakti fonton]
- Preparado per molekula rearanĝo de la izopropenila acetato:
Sintezo 3[redakti | redakti fonton]
- Preparado per interagado de natria etoksido kun acetono, etila acetato kaj klorida acido:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Preparado de fenilacetono: [8]
Reakcio 2[redakti | redakti fonton]
- Reakcio kun natria hidroksido: [9]
Reakcio 3[redakti | redakti fonton]
- Preparado de fera (III) triacetilacetonato:
Reakcio 4[redakti | redakti fonton]
- Preparado de dumetil pirazolo [(CAS-numero 67-51-6):
Reakcio 5[redakti | redakti fonton]
- Preparado de pirimidino:
Reakcio 6[redakti | redakti fonton]
- Enzima degradigo de la acetilacetono far la bakterio konata kiel Acinetobacter calcoaceticus: [10]
Literaturo[redakti | redakti fonton]
- Toxnet
- CNKI Arkivigite je 2019-02-18 per la retarkivo Wayback Machine
- VWR
- Handbook of sol-gel science and technology
- The Radiochemistry of Beryllium
- Organic Reagents in Metal Analysis
- Essentials of Organic Chemistry: For Students of Pharmacy, Medicinal Chemistry and Biological Chemistry
- Reag.paperplane Arkivigite je 2019-02-18 per la retarkivo Wayback Machine






![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)