Hipofluorita acido
| Hipofluorita acido | ||||

| ||||

| ||||

| ||||
| Alternativa(j) nomo(j) | ||||
| Hipofluorito de hidrogeno | ||||
| Kemia formulo | HFO | |||
| PubChem-kodo | 123334 | |||
| ChemSpider kodo | 109936 | |||
| CAS-numero-kodo | 14034-79-8 | |||
| Fizikaj proprecoj | ||||
| Aspekto | palflava likvaĵo super −117 °C
| |||
| Molmaso | 36.0057 g mol−1 | |||
| Smiles | OF | |||
| Denseco | 1,143 g/cm3 (likva) | |||
| Fandopunkto | −117 °C (−179 ℉; 156 K) | |||
| Bolpunkto | inter 10 °C kaj 20 °C | |||
| Solvebleco |
| |||
| Mortiga dozo (LD50) | toksa substanco | |||
| Ekflama temperaturo | malstabila substanco | |||
| Sekurecaj Indikoj | ||||
| Risko | ||||
| Sekureco | S12, S13, S17 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝo | |||
| GHS Deklaroj pri damaĝoj | H272, H312, H314, H315, H317, H318, H319, H320, H400 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P220, P221, P260, P262, P264, P273, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P337+313, P353, P360, P363, P370+378, P391, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
Hipofluorita acido estas kemia substanco kies molekula formulo estas HOF kaj ĝi estas peranto en la akvoksidado kun fluoro, estigante fluoridan acidon kaj oksigenon. Ĝi estas la sola hipohalogenida acido kiu izoleblas kiel solido. Hipofluorito de hidrogeno estas eksplodema kaj malkomponiĝas en oksigenon kaj fluoridan acidon. Ĝi estis unue izolita en la jaroj 1970 en ties pura formo pere de la glacifluorigo. En malaltaj temperaturoj HOF estas solido kiu fandiĝas je −117 °C fariĝante palflava likvaĵo kaj bolas en meditemperaturo.
La komponaĵo estis studita en la solida fazo per Ikso-radia kristalografio kiel iu molekulo kun angula geometrio je 101°. La longoj de la ligoj O-F kaj O-H estas respektive 144.2° kaj 96.4° pm. La solida strukturo konsistas je ĉenoj kun araĵoj O-H--O. La strukturo same estis analizita en gasa stato, kie la anguloligo H-O-F estas iom malpli ol 97.2 °.
Pri la fluoro, la sola oksoacido konata estas la hipofluorita acido. Ĝi estis produktita pasigante F2 sur glacio je −40 °C, kolektante la gason HOF sekvata de ties kondensiĝo.
F2 + H2O → HOF + HF
Ĝi eksplode malkomponiĝas en meditemperaturo por formi HF kaj O2
2 HOF → 2 HF + O2
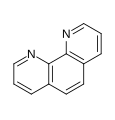
Hipofluorita acido kun acetonitrilo (ordinare pasante gasan fluoron tra humida acetonitrilo) agas kiel alte elektrofila agento por oksigena transigo. Traktante "fenantrolinon" per ĉi-reakcianto estiĝas la kompleksa "duoksido de 1,10 fenantrolino", 50 jaroj post la unua sensukcesa pruvo.
La saloj de la hipofluorita acido nomatas hipofluoritoj, kies konjuga bazo estas la jono OF−. La "trifluorometila hipofluorito" estas ekzemplo de tiu salo.
Literaturo[redakti | redakti fonton]
- Journal of the American Chemical Society
- Youtube
- Fluorine
- Reakcioj kun fluoro
- Quorahttp://chemistry.stackexchange.com/questions/10958/bond-angles-of-hypofluorous-acid-gas-and-solid-phases Chemistry StackExchange]
- Nist, National Institute of Standards and Technology]
- Chemistry Master
- Indole oxydation Arkivigite je 2015-06-23 per la retarkivo Wayback Machine
- Wiley Online Library
- Chem World
- Concise Encyclopedia Chemistry, Mary Eagleson
- Chemistry: Media Enhanced Edition, Steven Zumdahl, Susan Zumdahl
- Inorganic Chemistry, Egon Wiberg, Nils Wiberg
- Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol ..., R. Alan Aitken, Mateo Alajarin, D. W. Allen, Mikael Begtrup, Daniel Bellus, J. Berna-Canovas, H. Boeckemeier, Stefan Bräse, I.R. Butler, Jose Chiara, Henri-J. Cristau, I. Gorrell, D. Keck, Terence Kee, Carmen Lopez-Leonardo, T. Muller, Patrick J. Murphy, Patrick O'Leary, Beate Priewisch, L.K. Rasmussen, Karola Rück-Braun, Bjoern Schlummer, Andreas Schmidt, Paul James Stevenson, J.C. Tebby, David Virieŭ
- F Fluorine: Compounds with Oxygen and Nitrogen
Vidu ankaŭ[redakti | redakti fonton]
-
Fenantrolino -
Funikono -
Trifluorometila hipofluorito
Mineralaj acidoj[redakti | redakti fonton]
| Halogenidaj acidoj | |||||||
| HF | Fluorida acido | HCl | Klorida acido | HBr | Bromida acido | HI | Jodida acido |
| HFO | Hipofluorita acido | HClO | Hipoklorita acido | HBrO | Hipobromita acido | HIO | Hipojodita acido |
| HFO2 | Fluorita acido | HClO2 | Klorita acido | HBrO2 | Bromita acido | HIO2 | Jodita acido |
| HFO3 | Fluorata acido | HClO3 | Klorata acido | HBrO3 | Bromata acido | HIO3 | Jodata acido |
| HFO4 | Perfluorata acido | HClO4 | Perklorata acido | HbrO4 | Perbromata acido | HIO4 | Perjodata acido |