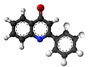
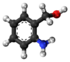
Kinolono
| 4-Kinolono | ||||
 | ||||
| Plata kemia strukturo de la p-kinolono | ||||
 | ||||
| Tridimensia kemia strukturo de la p-kinolono | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 529-37-3 | |||
| ChemSpider kodo | 5816 | |||
| PubChem-kodo | 69141 | |||
| Fizikaj proprecoj | ||||
| Aspekto | blankaj aŭ flavecaj kristaloj | |||
| Molmaso | 145,161 g·mol-1 | |||
| Denseco | 1,034g cm−3 | |||
| Fandpunkto | 200°C[1] | |||
| Bolpunkto | 346,7°C | |||
| Solvebleco | Akvo:Malmulte solvebla | |||
| Mortiga dozo (LD50) | 331 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R21 R22 | |||
| Sekureco | S20 S21 S22 S36/37/39 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Averto | |||
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |||
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P321, P332+313, P337+313, P362, P403+233, P405, P501[2] | |||
(25 °C kaj 100 kPa) | ||||
Kinolono aŭ C9H7NO estas organika aromata komponaĵo, apartenanta al la familio de la kinolinoj, blankaj kristaloj kiuj oscilas en la likva formo sub la taŭtomera formoj de la alkohola hidrokso-kinolino kaj la ketono formo de la kinolono. Krom la pedagogia intereso, kinolonoj reprezentas grandan klason da gravaj drogoj kun biologiaj proprecoj.
Proprecoj[redakti | redakti fonton]
Kutime, la kemia sintezo de la kinolonoj implicas en ringofermaj reakcioj. Tiaj reakcioj ofte rezultas en pozicio de hidroksila grupo sur la nitrogena ringo. Kinolinoj, fluorokinolinoj, klorokinolinoj, hidroksokinolinoj kaj la samaj derivaĵoj por la kinolonoj (fluorokinolono, klorokinolono, hidroksokinolono, fenilkinolono) estas gravaj farmaciaĵoj uzataj en la traktado kontraŭ tuberkulozo, artritoj, kontraŭinflamaĵoj, antibakteriaĵoj, krom la produktoj uzataj en la medicina kemio kaj agrikulturo.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per reakcio inter 2-amino-benzoata acido kaj acetileno:
Sintezo 2[redakti | redakti fonton]
- Preparado per reakcio inter 2-amino-benzila alkoholo kaj acetileno en ĉeesto de oksidiganto:
Sintezo 3[redakti | redakti fonton]
- Preparado per reakcio inter 2-amino-benzaldehido kun acetileno:
Sintezo 4[redakti | redakti fonton]
- Preparado per interagado de anilino kaj 1,3-dufluoro-2-propanolo:
Sintezo 5[redakti | redakti fonton]
- Preparado per interagado de anilino kaj 1,3-dukloro-2-propanolo:
Sintezo 6[redakti | redakti fonton]
- Preparado per interagado de anilino kaj 1,3-dukloro-ketono:
Sintezo 7[redakti | redakti fonton]
- Preparado per traktado de anilino kaj 1,3-propanoduolo:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Taŭtomera ekvilibro de la kinolona molekulo oscilante inter la alkohola funkcio kaj ketona grupo:
Reakcio 2[redakti | redakti fonton]
- Preparado de fluoro-kinolono:[3][4] Fluorokinolonoj estas efikaj kontraŭ vasta gamo da malsanoj kaŭzataj de bakterioj. Ili estas aprobataj de la Administrejo por Nutraĵoj kaj Drogoj por traktado de tuberkulozo, spirmalsanoj, haŭto-infektaĵoj kaj por prizorgoj kontraŭ la urinaj infektagentoj.[5]
Reakcio 3[redakti | redakti fonton]
- Preparado de 2-kloro-4-kinolono: [6]
Reakcio 4[redakti | redakti fonton]
- Preparado de 2-hidrokso-4-kinolono:
Reakcio 5[redakti | redakti fonton]
- Preparado de metil-kinolono:
Reakcio 6[redakti | redakti fonton]
- Preparado de 2-fenil-4-kinolono:
Literaturo[redakti | redakti fonton]
- Organic Chemistry Portal
- American Family Physician
- The Cochrane Collaboration Arkivigite je 2019-02-18 per la retarkivo Wayback Machine
- Nature
- Science Direct
- Drugs.com
- The Quinolones





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)
![{\displaystyle {\mathsf {{\xrightarrow[{-\,2\,H_{2}O}]{KMnO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b562565c909b84a5edf417ba8aeaa8f34116092)


![{\displaystyle {\mathsf {{\xrightarrow[{}]{KMnO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dfb7bf7200ad1ff303913ea91a8a635c60a816c0)


![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{KMnO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0eec0509b34cb7b5a3cd9270769fae6208ceaed)