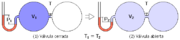Leĝo de Boyle: Malsamoj inter versioj
| [nekontrolita versio] | [nekontrolita versio] |
Enhavo forigita Enhavo aldonita
D'ohBot (diskuto | kontribuoj) e roboto aldono de: fa:قانون بویل |
e roboto forigo de: fr:Loi de Mariotte, nl:Wet van Boyle, uk:Закон Бойля-Маріотта |
||
| Linio 28: | Linio 28: | ||
[[fa:قانون بویل]] |
[[fa:قانون بویل]] |
||
[[fi:Boylen laki]] |
[[fi:Boylen laki]] |
||
[[fr:Loi de Mariotte]] |
|||
[[ga:Dlí Boyle]] |
[[ga:Dlí Boyle]] |
||
[[gd:Dlighe Úi Bhaoghail]] |
[[gd:Dlighe Úi Bhaoghail]] |
||
| Linio 40: | Linio 39: | ||
[[ko:보일의 법칙]] |
[[ko:보일의 법칙]] |
||
[[ms:Hukum Boyle]] |
[[ms:Hukum Boyle]] |
||
[[nl:Wet van Boyle]] |
|||
[[nn:Boyle si lov]] |
[[nn:Boyle si lov]] |
||
[[no:Boyle-Mariottes lov]] |
[[no:Boyle-Mariottes lov]] |
||
| Linio 53: | Linio 51: | ||
[[sv:Boyles lag]] |
[[sv:Boyles lag]] |
||
[[tr:Boyle yasası]] |
[[tr:Boyle yasası]] |
||
[[uk:Закон Бойля-Маріотта]] |
|||
[[vi:Định luật Boyle-Mariotte]] |
[[vi:Định luật Boyle-Mariotte]] |
||
[[zh:玻意耳-马略特定律]] |
[[zh:玻意耳-马略特定律]] |
||
Kiel registrite je 15:49, 15 feb. 2010
La leĝo de Boyle diras, ke
Ekzemple, se la premo de unu gaso duobliĝas, la volumeno de la gaso reduktiĝos duone, kaj same inverse. La leĝon ektrovis en 1662 la irlanda fizikisto kaj ĥemiisto Robert Boyle.
Eksteraj ligiloj
greke http://www.thescubaguide.com/certification/boyles-law.aspx greke http://dbhs.wvusd.k12.ca.us/webdocs/GasLaw/Gas-Boyle-Data.html