Dinitrogena trioksido
| Dinitrogena trioksido | |||||
 | |||||
| Plata kemia strukturo de la Dinitrogena trioksido | |||||
 | |||||
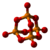
| Tridimensia kemia strukturo de la Dinitrogena trioksido | |||||
 | |||||
| Johann Rudolph Glauber sintezis dinitrogenan trioksidon en 1649. | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 10544-73-7 | ||||
| ChemSpider kodo | 55446 | ||||
| PubChem-kodo | 61526 | ||||
| Merck Index | 15,3307 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | toksa, eksplodema, forte blua gaso, kun penetranta odoro, solvebla en akvo kaj etero | ||||
| Molmaso | 76,011 g·mol−1 | ||||
| Denseco | 1,447g cm−3 | ||||
| Fandpunkto | −100 °C | ||||
| Bolpunkto | 3,5 °C | ||||
| Refrakta indico | 1,5184 | ||||
| Solvebleco | Akvo:reakcias | ||||
| Mortiga dozo (LD50) | 18 ppm (flare) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R26 R34 | ||||
| Sekureco | S1/2 S9 S26 S28 S36/37/39 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H270, H280, H310+330, H310, H314, H330 | ||||
| GHS Deklaroj pri antaŭgardoj | P220, P244, P260, P262, P264, P270, P271, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P361, P363, P370+376, P403, P403+233, P405, P410+403, P501[1] | ||||
(25 °C kaj 100 kPa) | |||||
Dinitrogena trioksido aŭ dunitrogena trioksido (ĥemia formulo N2O3) estas neorganika nitrogena kemia komponaĵo de oksigeno, toksa, eksplodema, intense blukobalta gaso (sub malaltaj temperaturoj), kun penetranta odoro, solvebla en akvo kaj etero, uzata en kemiaj sintezoj kiel oksidigagento kaj nitrogenigagento. Sub media temperaturo ĝi formas ekvilibran miksaĵon kun nitrogena dioksido.
La nitrogenatomo de la dinitrogena trioksido estas trivalenta (3+) kaj oksidigas aldehidojn kaj alkoholojn al karboksilataj acidoj. Ĝi estas la sola nitrogena oksido kiu povas ekzisti sub la gasa, likva kaj solidaj formoj (sub malaltegaj temperaturoj, kompreneble)[2]. Dinitrogena trioksido estis unue sintezita en 1648 fare de la germana alkemiisto Johann Rudolf Glauber (1604-1670).
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per agado de nitrata acido sur arsena trioksido:
Sintezo 2[redakti | redakti fonton]
- Preparado per traktado de nitrata acido sur arsena trioksido en akva medio:
Sintezo 3[redakti | redakti fonton]
- Preparado de dinitrogena trioksido (blukolora substanco en malaltaj temperaturoj) per interagado de nitrata oksido (senkolora substanco)kaj nitrogena dioksido (brunkolora substanco):
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Malkomponado de dinitrogena trioksido. Ĉi reakcio estas videble konstatebla pro tio ke blukolora dunitrogena duoksido iĝas en senkoloran nitratan oksidon kaj brunkoloran nitrogenan dioksidon:[3]
Reakcio 2[redakti | redakti fonton]
- Hidrolizo de dinitrogena trioksido:
Reakcio 3[redakti | redakti fonton]
- Preparado de nitrozil-sulfonata acido:
Reakcio 4[redakti | redakti fonton]
- Sintezo de natria nitrito:
Reakcio 5[redakti | redakti fonton]
- Preparado de nitrogena triklorido:
Reakcio 6[redakti | redakti fonton]
- Preparado de nitrozila klorido:
Reakcio 7[redakti | redakti fonton]
- Preparado de nitrozila bromido:
Reakcio 8[redakti | redakti fonton]
- Preparado de nitrozo-dietilamino:
Reakcio 9[redakti | redakti fonton]
- Sintezo de acetata acido:
Reakcio 10[redakti | redakti fonton]
- Dinitrogena trioksido eksplode reakcias kun hidrazino:
Reakcio 11[redakti | redakti fonton]
- Preparado de nitrozo-benzeno:
Literaturo[redakti | redakti fonton]
- The Health Effects of Nitrate, Nitrite, and N- Nitroso Compounds
- Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens
- Chemistry Arkivigite je 2018-12-29 per la retarkivo Wayback Machine
- General Chemistry
- Nitrous Oxide Performance Handbook
- Free Radicals and Inflammation









![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)