Endoterma reakcio
Endoterma estas nomata kemia reakcio, dum kiu necesas alporti energion. La kontraŭo estas la ekzoterma reakcio. Dum la endoterma reakcio la tiel nomata rekacientalpio estas pozitiva.[1] La entalpio H estas la sumo de la interna energio de la sistemo kaj de la produto de ĝia premo kaj volumeno. Ĝi estas la enhavo de varmo ĉe konstanta premo.[2] Sekve dum endoterma reakcio energio estas enprenata energio en formo de varmo el la ĉirkauo. Se oni nomas la diferencon de la entalpioj de la finaj () kaj komencaj substancoj, t.e. la sorbita energio, por endotermaj reakcioj validas: .
Sinsekvo de la reakcio
[redakti | redakti fonton]La reakcio disvolviĝas en du paŝoj. Unue necesas alporti la energion de aktivado. Sekve parto de tiu energio estas cedata. La cedata energio estas pli malgranda ol la energio de aktivado kaj sekve ĝi ne sufiĉas por daŭre subteni la reakcion. Tial necesas daŭra alporto de ekstera energio por ke la reakcio ne ĉesu.
Por ebligi endoterman reakcion, necesas ke ĝi estu favorigita pro la pligrandiĝo de la entropio kaj sekve havu liberan entalpion. Tial endotermaj reakcioj okazas ofte ĉe altaj temperaturoj. Tio montriĝas ekzemple en la ekvilibro de Boudouard, dum kiu ĉe altaj temperaturoj okazas la reakcio kiu estiĝas karbonan unuoksidon.
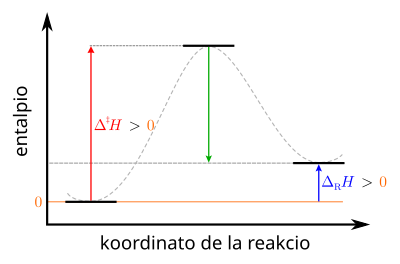
|
Klarigo de la simboloj:
|
Ekzemplo: Se oni aldonas vaporon al ardanta koakso okazas endoterma reakcio: .
Referencoj
[redakti | redakti fonton]- ↑ Noto pri endothermic reaction.
- ↑ Noto pri enthalpy, H. En: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.









