Metila tiocianato
| Metila tiocianato | ||||
 | ||||
Metila tiocianato | ||||
 | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
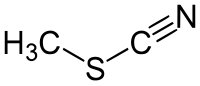
| Kemia formulo | ||||
| CAS-numero-kodo | 556-64-9 | |||
| ChemSpider kodo | 10695 | |||
| PubChem-kodo | 11168 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora likvaĵo kun malagrabla odoro[1] | |||
| Molmaso | 73,113g mol−1 | |||
| Denseco | 1,074g/cm−3 | |||
| Fandpunkto | −5 °C[2] | |||
| Bolpunkto | 123,1 °C[3] | |||
| Refrakta indico | 1,469 | |||
| Ekflama temperaturo | 38,3 °C[4] | |||
| Solvebleco | Akvo:malmulte solvebla | |||
| Mortiga dozo (LD50) | 57 mg/kg (buŝe) | |||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H226, H301, H311, H315, H319, H330, H331, H335 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P280, P284, P301+310, P302+352, P303+361+353, P304+340, P305+351+338, P310, P311, P312, P320, P321, P330, P332+313, P337+313, P361, P362, P363, P370+378 | |||
(25 °C kaj 100 kPa) | ||||
Metila tiocianato estas organika kombinaĵo kies kemia formulo estas H3C-S-C≡N apartenanta al la funkcia grupo de la tiocianatoj kaj rezultanta el interagoado de la tiocianata acido kaj metanolo. Ĝi estas la plej simpla strukturo el la organikaj tiocianatoj kaj ĝia aspekto estas senkolora likvaĵo kun ajlodoro.
Ĝi ankaŭ estas produktebla per metiligo de la tiocianataj saloj. La metila estero de la tiocianata acido estas brulema substanco kaj treege danĝera. Ĝi estas nesolvebla en akvo kaj estas uzata kiel insekticido, fumiĝaĵo kaj peraĵo por la sintezo de tiocianatoj kaj aliaj kemiaj kombinaĵoj. Metila tiocianato estas sulfurgusta kombinaĵo trovata en papajo, kio igas el la metila tiocianato potenca biomarkilo por la konsumado de ĉi-nutrado produkto.
Antidotoj por la cianidaj derivaĵoj inkludas hidroksokobalaminon kaj natrian nitriton (kiuj liberigas la cianidon el la citokroma sistemo) kaj rodanazo, kiu estas enzimo nature okazanta en mamuloj kombinanta sera cianido kun tiosulfato, kompare produktanta nedanĝeran tiocianaton. Oksigenoterapio ankaŭ eblas administri.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado de metila tiocianato per interagado de dumetila sulfato kun baria tiocianato:
Sintezo 2[redakti | redakti fonton]
- Preparado de metila tiocianato per interagado de tiocianata acido kun metanolo:
Sintezo 3[redakti | redakti fonton]
- Preparado de metila tiocianato per interagado de acetonitrilo kun tiosulfata acido:
Sintezo 4[redakti | redakti fonton]
- Preparado de metila tiocianato per interagado de kalia tiocianato kun metanolo:
Sintezo 5[redakti | redakti fonton]
- Preparado de metila tiocianato per interagado de klorometano kun tiocianata acido:
Sintezo 6[redakti | redakti fonton]
- Preparado de metila tiocianato per interagado de metanotiolo kun cianogena klorido:
Reakcio 1[redakti | redakti fonton]
- Preparado de fera (III) tiocianato per interagado de metila tiocianato kun fera (III) klorido:





![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)



![{\displaystyle {\mathsf {{\xrightarrow[{medio}]{acida}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/729812377dfa6c0a1823f037f23142eb8ce21fe5)