Ciklo de Krebs

La ciklo de Krebs (ankaŭ konata kiel ciklo de trikarboksilaj acidoj aŭ citr-acida ciklo) estas aro de reakcioj, kiuj estas centra parto de la elĉerpado de energio el nutraĵoj (per la katabolo de karbonhidratoj, lipidoj kaj proteinoj por fine produkti karbonan dioksidon kaj ATP-molekulojn). Ĝi estas unu el la plej gravaj cikloj de ĉiuj ĉeloj, kies ĉelspirado okazas per oksigeno (do, ĉiuj ĉeloj, kiuj havas mitokondriojn). Tiun ĉi ciklon malkovris la Nobel-premiitoj Albert Szent-Györgyi kaj Hans Krebs.
Ĝenerala vido
[redakti | redakti fonton]La neta reakcio de la ciklo estas:
acetil-CoA + 3 NAD+ + FAD + ADP + Pi → CoA + 3 NADH + H+ + FADH2 + ATP + 2 CO2
El unu glukoz-molekulo oni elĉerpas entute 36 ATP-molekulojn (se oni konsideras la tri fazojn de ĉelspirado: glikolizo, ciklo de Krebs, kaj transport-ĉeno de elektronoj). Oni fakte akiras 38 ATP-molekulojn, tamen du el ili estas uzitaj por transporti el citoplasmo al mitokondria matrico la du molekulojn de acetila koenzimo A, kiuj fariĝas dum glikolizo.
Reakcioj de la ciklo de Krebs
[redakti | redakti fonton]Reakcio 1: citrata sintazo
[redakti | redakti fonton]
 |
La enzimo citrata sintazo katalizas la kondensiĝon de la oksaloacetata acido kun la acetila CoA, donante citraton. La reakcio estas tre energidona (ΔG'°=-31.4 kJ/mol), tial tiu ĉi faso estas ege neinversigebla. La citrato produktita povas inhibiciigi la aktivecon de la enzimo. Pro tio ĉi, eĉ se la reakcio estas tre energidona, la citrata sintazo povas esti reguligita. Tiu ĉi aspekto estas biologie tre grava, pro tio, ke ĝi permesas plen-reguladon de la tuta ciklo de Krebs. |
 |
Reakcio 2: akonitazo
[redakti | redakti fonton]
 |
La akonitazo katalizas la isomerigon de la citrato al isocitrato (per formiĝo de cis-akonitato). Tiu ĉi enzimo katalizas ankaŭ la mala reakcio, sed en la ciklo de Krebs tiu ĉi reakcio estas unudirekta, pro la leĝo de reakcio de masoj: la koncentriteco (en standardaj kondiĉoj) de citrato (91%) de la cis-akonitato (3%) kaj isocitrato (6%) puŝas la reakcion al produktado de isocitrato. |
 |
Reakcio 3: isocitrata malhidrogenazo
[redakti | redakti fonton]
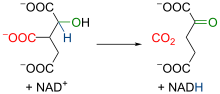 |
La mitokondria isocitrata malhidrogenazo estas enzimo, kiu dependas de la ĉeesto de NAD+ kaj de Mn2+ kaŭ Mg2+. Komence, la enzimo katalizas la oksidadon de la isocitrato al oksalasukcenato, kiu produktas molekulon de NADH el NAD+. Poste, la ĉeesto de unu du-valenta jono plialtiĝas la elektronegativecon de parto de tiu molekulo. Pro tio ĉi, la elektronoj de la molekulo relokiĝas, kaj tio ĉi rompas la ligon de karboksila grupo. Tiamaniere, la enzimo perdas molekulon de CO2, kreante la α-ketoglutarata malhidrogenazo (t.e. alfa-ketoglutarata). |
 |
Reakcio 4: α-ketoglutarata malhidrogenazo
[redakti | redakti fonton]
 |
Post la iĝo de isocitrato al α-ketoglutarata (t.e. alfa-ketoglutarata) malhidrogenazo, okazas oksidiga dekarboksilacio. Tio ĉi produktas sukcenan koenzimon A. La oksidiga dekarboksilacio de α-ketoglutarata malhidrogenazo tre similas al tiu de la piruvato. Ambaŭ reakcioj inkludas la dekarboksilacio de α-ketoacido, produktante altenergian tioesteron per koenzimo A. La kataliziloj de tiu ĉi reakcio tre similas inter ili. La α-ketoglutarata malhidrogenazo fariĝas de tri malsamaj enzimoj:
E1 kaj E2 estas tre similaj al piruvata malhidrogenazo. |
 |
Reakcio 5: sukcena CoA sintetazo
[redakti | redakti fonton]
 |
La sukcena koenzimo A (aŭ sukcena CoA) estas altenergia tioestero (ĝia hidroliza ΔG°′ estas ĉirkaŭ -33.5 kJ/mol, simila al tiu de ATP, kiu estas -30.5 kJ/mol). La enzimo sukcena CoA-sintetazo uzas tiun energion por forforiligi GDP-on, produktante GTP-on (post kelkaj paŝoj) kaj la sukcena CoA transformiĝas en sukcenato. |
 |
Reakcio 6: sukcena malhidrogenazo
[redakti | redakti fonton]
 |
La fina parto de la ciklo rearanĝas la molekulojn de kvar atomoj de karbono reproduktante oksoalacetaton. Pro tio, la metila grupo, kiu troveblas en la sukcenato, devas transformiĝi al karbonilo. Samkiel okazas en aliaj vojoj (kiel ekzemple la beta-oksidiĝo de grasaj acidoj), tiu ĉi transformiĝo okazas tripaŝe: oksidigo (per sukcena malhidrogenazo), hidratigo (per fumarazo) kaj dua oksidigo (per malata malhidrogenazo). Tiel, dum oni rehavigas oksalacetaton, oni elĉerpas pli da energio kreante FADH2-on kaj NADH-on. La sukcena malhidrogenazo katalizas la unuan oksidigon. Tiu ĉi enzimo estas la nura en la ciklo de Krebs, kiu akceptas hidrogenon el FAD, kaj ne el NAD+. Ĝi estas ankaŭ la nura, kiu troveblas ene de la mitokondria membrano. |
 |
Reakcio 7: fumarazo
[redakti | redakti fonton]
 |
Fumarazo katalizas la adicion de protono transe, kaj de OH-grupo el akvo. Tiel, fumarato transformiĝas en L-malato (kaj ne D-malato, pro tio, ke la enzimo nur povas ligi la OH-grupon al unu flanko de fumarato). |
 |
Reakcio 8: malata malhidrogenazo
[redakti | redakti fonton]
 |
La lasta reakcio de la ciklo temas pri oksidigo de malato al oksoalacetato. Malata malhidrogenazo katalizas tiun ĉi reakcion akirante NAD+-on kaj produktante NADH. La energio de Gibbs de tiu ĉi lasta reakcio estas pozitiva (tio ĉi ne okazas en la aliaj partoj de la ciklo). Tamen, tiu ĉi enzimo aktiviĝas, pro tio, ke la oksalacetato konsumiĝas pro la aktiveco de la citrata sintazo (kaj NADH) ĉe la transport-ĉeno de elektronoj. |
 |
Referencoj
[redakti | redakti fonton]- ↑ C. Usher, J. Remington, P. Martin, G. Drueckhammer, A very short hydrogen bond provides only moderate stabilization of an enzyme-inhibitor complex of citrate synthase. In: Biochemistry 33, S. 7753-7759, 1994
- ↑ H. Lauble, C. D. Stout: Steric and conformational features of the aconitase mechanism. In: Proteins 22, S. 1-11 , 1995
- ↑ Mesecar, A.D., Stoddard, B.L., Koshland Jr., D.E. Orbital steering in the catalytic power of enzymes: small structural changes with large catalytic consequences. Science v277 pp.202-206 , 1997
- ↑ Fraser, M.E., James, M.N., Bridger, W.A., Wolodko, W.T. Phosphorylated and dephosphorylated structures of pig heart, GTP-specific succinyl-CoA synthetase. J.Mol.Biol. v299 pp.1325-1339, 2000
- ↑ V. Yankovskaya, R. Horsefield, S. Tornroth, C. Luna-Chavez, H. Miyoshi, C. Leger, B. Byrne, G. Cecchini, S. Iwata: Architecture of succinate dehydrogenase and reactive oxygen species generation. In: Science 299, S. 700-704, 2003
- ↑ Weaver, T., Lees, M., Zaitsev, V., Zaitseva, I., Duke, E., Lindley, P., McSweeny, S., Svensson, A., Keruchenko, J., Keruchenko, I., Gladilin, K., Banaszak, L. Crystal structures of native and recombinant yeast fumarase. J.Mol.Biol. v280 pp.431-442 , 1998
- ↑ Tomita, T., Fushinobu, S., Kuzuyama, T., Nishiyama, M. Structural basis for alteration of cofactor specificity of malate dehydrogenase from Thermus flavus
