Fosfora trioksido
| Fosfora trioksido | ||||
 | ||||
| Plata kemia strukturo de la Fosfora trioksido | ||||
 | ||||
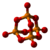
| Tridimensia kemia strukturo de la Fosfora trioksido | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 1314-24-5 | |||
| ChemSpider kodo | 109897 | |||
| PubChem-kodo | 123290 | |||
| Merck Index | 15,7472 | |||
| Fizikaj proprecoj | ||||
| Aspekto | toksaj, senkoloraj, unuklinaj kristaloj aŭ likvaĵo kun ajlodoro | |||
| Molmaso | 219,889 g·mol-1 | |||
| Denseco | 2,135g cm−3 | |||
| Fandpunkto | 23,8°C | |||
| Bolpunkto | 173,1°C | |||
| Refrakta indico | 1,5398 | |||
| Acideco (pKa) | 9,4 | |||
| Solvebleco | Akvo:reakcias | |||
| Mortiga dozo (LD50) | 18 mg/kg (buŝe)[1] | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R35 R50 R51 | |||
| Sekureco | S22 S26 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H314, H318, H330 | |||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P271, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P363, P403+233, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
Fosfora trioksido aŭ P4O6, ankaŭ konata kiel fosfonata anhidrido estas neorganika kemia kombinaĵo el fosforo, toksaj, senkoloraj, unuklinaj kristaloj aŭ likvaĵo (pro ĝia malalta fandpunkto) kun malagrabla ajlodoro, kun kristala strukturo simile al la adamantino.
Ĝi povas esti produktita per senhidratigo de la fosfonata acido sed ĝiaj vaporoj estas ege toksaj. Ĝenerale oksidoj ne brulas en normalaj kondiĉoj sed fosfora trioksido ekbrulas kiam varmigita sub malferma atmosfero.[2]
En la 18-a jarcento Antoine Lavoisier (1743-1794) kaj Humphry Davy (1778-1829) jam konis ĉi-substancon dum la kondiĉoj pri formado kaj komponado estis raportitaj de Pierre Louis Dulong (1785-1838).
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per interagado de la elementoj sub malvarma temperaturo:
Sintezo 2[redakti | redakti fonton]
- Preparado per traktado de elementa fosforo kun karbona duoksido:
Sintezo 3[redakti | redakti fonton]
- Fosforo reakcias kun nitroza oksido por doni fosforan trioksidon kaj nitrogenon:[3]
Sintezo 4[redakti | redakti fonton]
- Sintezo per interagado de elementa fosforo kun fosfora kvinoksido:
Sintezo 5[redakti | redakti fonton]
- Sintezo per interagado de fosfonata acido kun fosfora triklorido:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Fosfora trioksido reakcias kun dekdu moloj da klorida acido por formi fosforan trikloridon kaj akvon:
Reakcio 2[redakti | redakti fonton]
- Tamen, fosfora trioksido reakcias kun ses moloj da klorida acido por formi fosforan trikloridon kaj fosfitan acidon:
Reakcio 3[redakti | redakti fonton]
- Reakcio kun malvarma akvo donas fosfonatan acidon:[4]
Reakcio 4[redakti | redakti fonton]
- Tamen, reakcio kun varma akvo donas fosfatan acidon kaj fosfinon:[4]
Reakcio 5[redakti | redakti fonton]
- Fosfita anhidrido reakcias kun klorgaso por doni fosforilan kloridon kaj oksigenon:
Literaturo[redakti | redakti fonton]
- Encyclopaedia of Occupational Health and Safety: Guides, indexes, directory
- The Chemistry of Phosphorus: Pergamon Texts in Inorganic Chemistry
- Practical Guide to Industrial Safety: Methods for Process Safety Professionals
- TNPCEE Chemistry
- Wiley Guide to Chemical Incompatibilities
- Conceptual Chemistry Volume-I For Class XII
Referencoj[redakti | redakti fonton]
- ↑ TCI America. Arkivita el la originalo je 2018-11-25. Alirita 2018-11-25.
- ↑ A Comprehensive Guide to the Hazardous Properties of Chemical Substances
- ↑ The Chemistry of Phosphorus: Pergamon Texts in Inorganic Chemistry
- ↑ 4,0 4,1 The Pearson Guide to Objective Chemistry for the AIEEE








![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)