Kalorimetrio


Kalorimetrio estas la scienco pri la mezurado de atributoj de kemiaj reakcioj aŭ fizikaj ŝanĝoj aŭ fazaj ŝanĝoj por kalkuli la varmon asociitan kun tiuj ŝanĝoj. Kalorimetrio estas farata per kalorimetro. La vorto kalorimetrio estas derivita de la latina calor, kun la signifo varmo kaj la greka vorto μέτρον (metron), kun la signifo mezuro. Skota kuracisto kaj sciencisto Joseph Black, kiu estis la unua kiu rekonis la distingon inter varmo kaj temperaturo, laŭdire estas la fondinto de la scienco de kalorimetrio.[2]
Per nerekta kalorimetrio oni kalkulas la varmon kiun produktas vivantaj organismoj, mezurante aŭ la produktadon de karbondioksido kaj forĵetita nitrogeno, (ofte amoniako en akvaj organismoj, aŭ ureo en surteraj), aŭ de la konsumo de oksigeno. Lavoisier notis en 1780 ke varmoproduktado povas esti tiel antaŭdirita de oksigenforuzo, uzante multoblan regreson. La teorio pri Dinamika EnergiBuĝeto klarigas kial tiu metodo estas ĝusta. Varmo generita de vivantaj organismoj estas mezurebla per rekta kalorimetrio, en kiu la tuta organismo estas metita en kalorimetron por la mezurado.
La aparato diferenca skana kalorimetrio, ebligas registri datumojn pri malgrandaj kvantoj de materio. La aparato hejtas la provaĵon laŭ regata rapido kaj registras la varmofluon aŭ en aŭ el la specimeno.
Klasika kalorimetra kalkulo de varmo[redakti | redakti fonton]
Baza klasika kalkulo kun respekto al volumeno[redakti | redakti fonton]
Kalorimetrio postulas ke la materio varmigata havu konatajn termikajn konstituigajn atributojn. La klasika regulo, rekonita de Clausius kaj de William Thomson, estas ke la premo de la kalorimetra materio estas plene kaj rapide determinebla sole laŭ ĝia temperaturo kaj volumeno; tiu regulo estas por ŝanĝoj kiuj ne implikas fazoŝanĝon, ekzemple fandado de glacio. Ekzistas multaj materioj kiuj ne obeas tiun regulon, kaj por ili, la nuna formulo de klasika kalorimetrio ne disponigas adekvatan klarigon. Ĉi tie ni supozas ke la klasika regulo validas por la kalorimetra materio uzata, kaj ni skribas la ekvaciojn matematike.
La termika respondo de la kalorimetra materio estas plene priskribebla laŭ ĝia premo kiel la valoro de ĝia konstituiga funkcio de nur la volumeno kaj la temperaturo . Ĉiuj pliigoj devas esti tre malgrandaj.
Kiam malgranda pliigo de varmo estas akirita de kalorimetra korpo, kun malgrandaj pliigoj, de ĝia volumeno, kaj de ĝia temperaturo, la pliigo de varmo, , akirita de la korpo de kalorimetra materio, priskribeblas jene
kie
- indikas la latentan varmon kun respekto al volumeno, de la kalorimetra materio ĉe konstanta temperaturo, dum la premo kaj volumeno de la materio estas permesitaj varii libere, ĉe volumeno kaj temperaturo .
- indikas la varmokapaciton, de la kalorimetra materio ĉe konstanta volumeno, dum la premo kaj temperaturo de la materio estas permesitaj varii libere, ĉe volumeno kaj temperaturo . Estas kutime skribi simple kiel , aŭ eĉ pli mallonge kiel .[3][4][5][6][7][8][9].
La latenta varmo kun respekto al volumeno estas la varmo necesa por unita pliigo en volumeno ĉe konstanta temperaturo. Oni povas diri 'mezuri ĝin laŭlonge de izotermo'. La premo kiun la materio premas, estas permesita varii libere, laŭ ĝia konstituiga leĝo . Por donita materio, ĝi povas havi pozitivan aŭ negativan signumon aŭ escepte ĝi povas esti nula, kaj tio povas dependi de la temperaturo, kiel ĝi faras por akvo je ĉirkaŭ 4 °C.[10][11][12][13] La koncepto de latenta varmo kun respekto al volumeno eble estis unue rekonita de Joseph Black en 1762.[14] La esprimo 'latenta varmo de ekspansio' ankaŭ estas uzata.[15] La latenta varmo kun respekto al volumeno ankaŭ povas esti nomita la 'latenta energio kun respekto al volumeno'. Por ĉi tiuj uzoj de 'latenta varmo', pli sistema termino estas 'latenta varmokapacito'. La varmokapacito ĉe konstanta volumeno estas la varmo necesa por unita pliigo en temperaturo ĉe konstanta volumeno. Oni povas diri 'mezuri ĝin laŭlonge de izovolumeno', kaj denove, la premo povas varii libere. Ĝi ĉiam havas plusan signumon. Tio signifas ke por pliiĝo en la temperaturo de korpo sen ŝanĝo de sia volumeno, varmo devas esti provizita al ĝi. Tio estas kongrua kun ofta sperto. Kvantoj kiaj estas foje nomitaj 'kurbaj diferencialoj', ĉar ili estas mezuritaj laŭ kurboj en la surfaco .
Konstant-volumena kalorimetrio (Bomba kalorimetrio)[redakti | redakti fonton]
Konstant-volumena kalorimetrio estas kalorimetrio farata ĉe konstanta volumeno. Tio implikas la uzon de konstant-volumena kalorimetro. Varmo same estas mezurata per la supre deklarita principo de kalorimetrio. Tio signifas ke en konvene konstruita kalorimetro, la pliigo de volumeno povas malaperi, . Por konstant-volumena kalorimetrio:
kie
- indikas la pliigon en temperaturo kaj
- indikas la varmokapaciton ĉe konstanta volumeno.
Klasika varmokalkulo kun respekto al premo[redakti | redakti fonton]
El la supra regulo pri la kalkulo de varmo kun respekto al volumeno, sekvas regulo kun respekto al premo.[3][7][16][17] En procezo de malgrandaj pliigoj, de ĝia premo, kaj de ĝia temperaturo, la pliigo de varmo, , akirita de la korpo de kalorimetra materio, estas priskribebla per
kie
- indikas la latentan varmon kun respekto al premo, de la kalorimetra materio ĉe konstanta temperaturo, dum la volumeno kaj premo de la korpo estas permesitaj varii libere, ĉe premo kaj temperaturo ;
- indikas la varmokapaciton, de la kalorimetra materio ĉe konstanta premo, dum la temperaturo kaj volumeno de la korpo povas varii libere, ĉe premo kaj temperaturo . Estas kutime skribi simple kiel , aŭ eĉ pli mallonge kiel .
La novaj kvantoj ĉi tie rilatas al la antaŭaj:[3][7][17][18]
kie
- indikas la partan derivaĵon de kun respekto al esplorite por
kaj
- indikas la partan derivaĵon de kun respekto al esplorite por.
La latentaj varmoj kaj estas ĉiam de la kontraŭa signumo.[19] Oni ofte nomas la rilatumon de specifaj varmoj
Kalorimetrio tra fazoŝanĝo[redakti | redakti fonton]
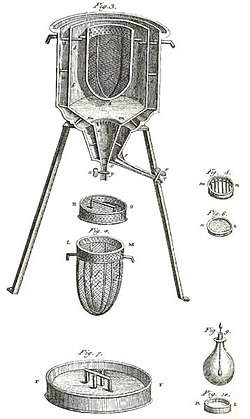
Frua kalorimetro estis tiu utiligita de Laplace kaj Lavoisier, kiel montrite en la supra bildo. Ĝi funkciis ĉe konstanta temperaturo, kaj ĉe atmosfera premo. La rilata latenta varmo tiam estis ne latenta varmo kun respekto al volumeno aŭ kun respekto al premo, kiel en supra klarigo por kalorimetrio sen fazoŝanĝo. La latenta varmo implikita en tiu kalorimetro estis kun respekto al fazoŝanĝo, nature okazanta ĉe konstanta temperaturo. Tiu speco de kalorimetro funkciis per mezurado de maso de akvo produktita per la fandado de glacio, kiu estas fazoŝanĝo.
Kumulado de hejtado[redakti | redakti fonton]
Por tempodependa procezo de hejtado de la kalorimetra materio, difinita per kontinua komuna progresado de kaj , komencante en tempo kaj finiĝante en tempo , tie eblas kalkuli akumuliĝintan kvanton de varmo liverita, . Tiu kalkulo estas farita per matematika integriĝo laŭlonge de la progresado kun respekto al tempo. Tio estas ĉar pliigoj de varmo estas 'adicaj'; sed tio ne signifas ke varmo estas konservativa kvanto. Lavoisier inventis la ideon ke varmo estis konservativa kvanto, kaj ĝi estas nomita la 'kaloria teorio'; ĝis de la mezo de la deknaŭa jarcento oni rekonis ke ĝi estis malĝusta. Skribite per la simbolo , la kvanto estas tute ne limigita esti pliigo kun tre malgrandaj valoroj; tio estas en kontrasto kun . Oni povas skribi
- .
Tiu esprimo uzas kvantojn, ekzemple , kiuj estas difinitaj en la sekva sekcio 'Matematikaj aspektoj de la supraj reguloj'.
Matematikaj aspektoj de la supraj reguloj[redakti | redakti fonton]
La uzo de 'tre malgrandaj' kvantoj, ekzemple , rilatas al la fizika postulo por la kvanto esti 'rapide determinita' per kaj ; tia 'rapida persistemo' rilatas al fizika procezo. Tiuj 'tre malgrandaj' kvantoj estas uzitaj en la aliro de Leibniz al la infinitezima kalkulo. La aliro de Newton uzas anstataŭe la metodon de fluksoj, kiel ekzemple , kiu igas ĝin pli evidenta ke devas esti 'rapide determinebla'. Laŭ fluksoj, la supra unua regulo de kalkulo skribiĝas[22]
kie
- indikas la tempon
- indikas la tempoftecon de hejtado de la kalorimetra materio en tempo
- indikas la tempoftecon de ŝanĝo de volumeno el la kalorimetra materio en tempo
- indikas la tempoftecon de temperaturŝanĝo de la kalorimetra materio.
La pliigo kaj la flukso akiriĝas por speciala tempo kiu determinas la valorojn de la kvantoj sur la dekstraj flankoj de la supraj reguloj. Sed tio ne estas kialo atendi ke tie devus ekzisti matematika funkcio . Tial, la pliigo laŭdire estas 'neperfekta diferencialo' aŭ 'neekzakta diferencialo'.[23][24][25] Kelkaj libroj indikas tion skribante anstataŭ .[26][27] Ankaŭ, la notacio đQ estas uzita en kelkaj libroj.[23][28] Neglektemo pri tio povas konduki al eraro.[29]
La kvanto laŭdire konvene estas funkcio de la kontinua komuna progresado de kaj , sed, en la matematika difino de funkcio ne estas funkcio de . Kvankam la flukso estas difinita ĉi tie kiel funkcio de tempo , la simboloj kaj respektive starante sola ne estas difinitaj ĉi tie.
Fizika amplekso de la supraj reguloj de kalorimetrio[redakti | redakti fonton]
La supraj reguloj rilatas nur al taŭgaj kalorimetraj materioj. La esprimoj 'rapide' kaj 'tre malgranda' vokas por empiria fizika kontrolado de la domajno de valideco de la supraj reguloj. La supraj reguloj por la kalkulo de varmo apartenas al pura kalorimetrio. Ili ne referas al termodinamiko, kaj estis plejparte komprenitaj antaŭ la apero de termodinamiko. Ili estas la bazo de la 'thermo' kontribuo al termodinamiko. La 'dinamiko' kontribuo estas bazita sur la ideo de laboro, kiu ne estas uzita en la supraj reguloj de kalkulo.
Eksperimente konvene mezureblaj koeficientoj[redakti | redakti fonton]
Empirie, estas oportune mezuri atributojn de kalorimetraj materioj sub eksperimente regataj kondiĉoj.
Premokresko ĉe konstanta volumeno[redakti | redakti fonton]
Por mezuradoj ĉe eksperimente regata volumeno, oni povas uzi la supozon, menciita supre, ke la premo de la korpo de kalorimetra materio estas esprimebla kiel funkcio de sia volumeno kaj temperaturo. Por mezuri ĉe konstanta eksperimente regata volumeno, la izovolumena koeficiento de premopliiĝo kun temperaturo, estas difinita per
- .[30]
Ekspansio ĉe konstanta premo[redakti | redakti fonton]
Por mezuri ĉe eksperimente regata premo, ni supozas ke la volumeno de la korpo de kalorimetra materio estas esprimebla kiel funkcio de ĝia temperaturo kaj premo . Tiu supozo rilatas al, sed ne estas la sama kiel, la supre uzita supozo ke la premo de la korpo de kalorimetra materio estas konata kiel funkcio de sia volumeno kaj temperaturo; nenormala konduto de materioj povas influi tiun rilaton. La kvanto kiu estas konvene mezurebla ĉe konstanta eksperimente regata premo, la isobara volumena ekspansiokoeficiento, estas difinita per
Kunpremeblo ĉe konstanta temperaturo[redakti | redakti fonton]
Por mezuradoj ĉe eksperimente regata temperaturo, ni denove supozas ke la volumeno de la korpo de kalorimetra materio estas esprimebla kiel funkcio de ĝia temperaturo kaj premo , kun la samaj kondiĉoj kiel menciite supre. La kvanto konvene mezurebla ĉe konstanta eksperimente kontrolata temperaturo, la izoterma kunpremeblo, estas difinita per
Rilato inter klasikaj kalorimetraj kvantoj[redakti | redakti fonton]
Supozante ke la regulo estas konata, oni povas derivi la funkcion kiu estas uzita supre en la klasika varmokalkulo kun respekto al premo. Tiu funkcio povas esti trovita eksperimente per la koeficientoj kaj tra la matematike deduktebla rilato
- .[37].
Ligo inter kalorimetrio kaj termodinamiko[redakti | redakti fonton]
Termodinamiko evoluis iom post iom dum la unua duono de la deknaŭa jarcento, konstruate sur la supra teorio de kalorimetrio kiu estis ellaborita antaŭ ĝi, kaj sur aliaj eltrovaĵoj. Laŭ Gislason kaj Craig (2005): "La plej multaj termodinamikaj datumoj venas de kalorimetrio ... "[38] Laŭ Kondepudi (2008): "Kalorimetrio estas vaste uzata en aktualaj laboratorioj."[39]
Laŭ termodinamiko, la interna energio de la kalorimetra materio povas esti konsiderita la valoro de funkcio de , kun partaj derivaĵoj kaj . Tiam povas esti montrite ke oni povas skribi termodinamikan version de la supraj kalorimetraj reguloj:
kun
kaj
Denove, plue laŭ termodinamiko, la interna energio de la kalorimetra materio povas foje, depende de la kalorimetra materio, esti konsiderata la valoro de funkcio de , kun partaj derivaĵoj kaj , kaj kun estante esprimebla kiel la valoro de funkcio de , kun partaj derivaĵoj kaj .
Tiam, laŭ Adkins (1975),[44] ni povas montri ke oni povas skribi plian termodinamikan version de la supraj kalorimetraj reguloj:
kun
kaj
- .[44]
Preter la kalorimetra fakto notita supre, ke la latentaj varmoj kaj estas ĉiam de la kontraŭa signo, ni povas montri, utiligante la termodinamikan koncepton de laboro, ankaŭ ke
Speciala intereso de termodinamiko en kalorimetrio: la izotermaj segmentoj de Carnot-ciklo[redakti | redakti fonton]
Kalorimetrio havas specialan avantaĝon por termodinamiko. Ĝi informas pri la varmo sorbita aŭ eligita en la izoterma segmento de Carnot-ciklo.
Carnot-ciklo estas speciala speco de cikla procezo influanta korpon kunmetitan de materio taŭga por uzo en termika motoro. Tia materio estas de la speco pripensita en kalorimetrio, kiel notite supre, tio premas premon kiu estas tre rapide determinebla simple per temperaturo kaj volumeno. Oni diras ke tia korpo ŝanĝiĝas inversigeble. Carnot-ciklo konsistas el kvar sinsekvaj stadioj aŭ segmentoj:
(1) ŝanĝo en volumeno ek de volumeno al volumeno ĉe konstanta temperaturo por altiri fluon de varmo en la korpon (konata kiel izoterma ŝanĝo)
(2) ŝanĝo en volumeno ek de al volumeno ĉe varia temperaturo tiel, kiel altiri neniun fluon de varmo (konata kiel izovarma ŝanĝo)
(3) alia izoterma ŝanĝo en volumeno ek de al volumeno ĉe konstanta temperaturo tiel, kiel altiri fluon de varmo el la korpo kaj tiel, kiel precize prepari por la sekvanta ŝanĝo
(4) alia izovarma ŝanĝo de volumeno ek de retro al tiel, kiel resendi la korpon al ĝia starta temperaturo .
En izoterma segmento (1), la varmo kiu fluas en la korpon estas
kaj en izoterma segmento (3) la varmo kiu fluas for el la korpo estas
- .[46]
Ĉar la segmentoj (2) kaj (4) estas adiabataj (izovarmaj), neniom da varmo fluas en aŭ el la korpo dum ili, kaj tial la neta varmo liverita al la korpo dum la ciklo estas
- .
Tiu kvanto estas uzita de termodinamiko kaj rilatas en speciala maniero al la neta laboro farita fare de la korpo dum la Carnot-ciklo. La neta ŝanĝo de la interna energio de la korpo dum la Carnot-ciklo, , estas egala al nul, ĉar la materio de la laboranta korpo havas la specialajn atributojn notitajn supre.
Speciala intereso de kalorimetrio en termodinamiko: rilatoj inter klasikaj kalorimetraj kvantoj[redakti | redakti fonton]
Rilato de latenta varmo kun respekto al volumeno, kaj la ekvacio de stato[redakti | redakti fonton]
La kvanto , la latenta varmo kun respekto al volumeno, apartenas al klasika kalorimetrio. Ĝi priskribas la okazon de energitransigo per laboro en procezo en kiu varmo ankaŭ estas trandonita; la kvanto, tamen, estis konsiderata antaŭ la rilato inter la transigo de varmo kaj laboro estis klarigita per la invento de termodinamiko. En la lumo de termodinamiko, la klasika kalorimetra kvanto estas rivelita esti intime ligita al la ekvacio de stato de la kalorimetra materio . Kondiĉe ke la temperaturo estas mezurita laŭ la termodinamika absoluta skalo, la rilato estas esprimebla per la formulo
- .[47]
Diferenco de specifaj varmoj[redakti | redakti fonton]
Altgrada termodinamiko disponigas la rilaton
- .
De tio, plua matematika kaj termodinamika rezonado kondukas al alia rilato inter klasikaj kalorimetraj kvantoj. La diferenco de specifaj varmoj estas
Libroj[redakti | redakti fonton]
- Adkins, C.J. (1975). Equilibrium Thermodynamics, second edition, McGraw-Hill, London, ISBN 0-07-084057-1.
- Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics, New York, ISBN 0-88318-797-3.
- Bryan, G.H. (1907). Thermodynamics. An Introductory Treatise dealing mainly with First Principles and their Direct Applications, B.G. Tuebner, Leipzig.
- Callen, H.B. (1960/1985). Thermodynamics and an Introduction to Thermostatistics, second edition, Wiley, New York, ISBN 981-253-185-8.
- Crawford, F.H. (1963). Heat, Thermodynamics, and Statistical Physics, Rupert Hart-Davis, London, Harcourt, Brace, & World.
- Guggenheim, E.A. (1949/1967). Thermodynamics. An Advanced Treatment for Chemists and Physicists, North-Holland, Amsterdam.
- Iribarne, J.V., Godson, W.L. (1973/1981), Atmospheric Thermodynamics, second edition, D. Reidel, Kluwer Academic Publishers, Dordrecht, ISBN 90-277-1296-4.
- Kondepudi, D. (2008). Introduction to Modern Thermodynamics, Wiley, Chichester, ISBN 978-0-470-01598-8.
- Landsberg, P.T. (1978). Thermodynamics and Statistical Mechanics, Oxford University Press, Oxford, ISBN 0-19-851142-6.
- Lewis, G.N., Randall, M. (1923/1961). Thermodynamics, second edition revised by K.S Pitzer, L. Brewer, McGraw-Hill, New York.
- Maxwell, J.C. (1872). Theory of Heat, third edition, Longmans, Green, and Co., London.
- Partington, J.R. (1949). An Advanced Treatise on Physical Chemistry, Volume 1, Fundamental Principles. The Properties of Gases, Longmans, Green, and Co., London.
- Planck, M. (1923/1926). Treatise on Thermodynamics, third English edition translated by A. Ogg from the seventh German edition, Longmans, Green & Co., London.
- Truesdell, C., Bharatha, S. (1977). The Concepts and Logic of Classical Thermodynamics as a Theory of Heat Engines, Rigorously Constructed upon the Foundation Laid by S. Carnot and F. Reech, Springer, New York, ISBN 0-387-07971-8.
Referencoj[redakti | redakti fonton]
- ↑ Reardon, Francis D.; Leppik, Kalle E.; Wegmann, René; Webb, Paul; Ducharme, Michel B.; & Kenny, Glen P. (2006). The Snellen human calorimeter revisited, re-engineered and upgraded: design and performance characteristics. Med Bio Eng Comput, 44:721–728.
- ↑ Laidler, Keith, J.. (1993) The World of Physical Chemistry. Oxford University Press. ISBN 0-19-855919-4.
- ↑ 3,0 3,1 3,2 Bryan, G.H. (1907), paĝoj 21–22.
- ↑ Partington, J.R. (1949), paĝoj 155–157.
- ↑ Prigogine, I., Defay, R. (1950/1954). Chemical Thermodynamics, Longmans, Green & Co, London, paĝoj 22-23.
- ↑ Crawford, F.H. (1963), Section 5.9, pp. 120–121.
- ↑ 7,0 7,1 7,2 Adkins, C.J. (1975), Section 3.6, paĝoj 43-46.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝoj 20-21.
- ↑ Landsberg, P.T. (1978), paĝo 11.
- ↑ Maxwell, J.C. (1872), paĝoj 232-233.
- ↑ Lewis, G.N., Randall, M. (1923/1961), paĝoj 378-379.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝoj 9-10, 15-18, 36-37.
- ↑ Truesdell, C.A. (1980). The Tragicomical History of Thermodynamics, 1822-1854, Springer, New York, ISBN 0-387-90403-4.
- ↑ Lewis, G.N., Randall, M. (1923/1961), paĝo 29.
- ↑ Maxwell, J.C. (1872), paĝo 73.
- ↑ Crawford, F.H. (1963), Section 5.10, pp. 121–122.
- ↑ 17,0 17,1 Truesdell, C., Bharatha, S. (1977), paĝo 23.
- ↑ Crawford, F.H. (1963), Section 5.11, pp. 123–124.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝo 24.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝo 25.
- ↑ Kondepudi, D. (2008), paĝoj 66-67.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝo 20.
- ↑ 23,0 23,1 Adkins, C.J. (1975), Section 1.9.3, paĝo 16.
- ↑ Landsberg, P.T. (1978), paĝoj 8-9.
- ↑ An account of this is given by Landsberg, P.T. (1978), Chapter 4, paĝoj 26-33.
- ↑ Fowler, R., Guggenheim, E.A. (1939/1965). Statistical Thermodynamics. A version of Statistical Mechanics for Students of Physics and Chemistry, Cambridge University Press, Cambridge UK, page 57.
- ↑ Guggenheim, E.A. (1949/1967), Section 1.10, pages 9-11.
- ↑ Lebon, G., Jou, D., Casas-Vázquez, J. (2008). Understanding Non-equilibrium Thermodynamics: Foundations, Applications, Frontiers, Springer-Verlag, Berlin, e-ISBN 978-3-540-74252-4, paĝo 7.
- ↑ 29,0 29,1 Planck, M. (1923/1926), paĝo 57.
- ↑ 30,0 30,1 Iribarne, J.V., Godson, W.L. (1973/1981), paĝo 46.
- ↑ 31,0 31,1 31,2 Lewis, G.N., Randall, M. (1923/1961), paĝo 54.
- ↑ 32,0 32,1 Guggenheim, E.A. (1949/1967), paĝo 38.
- ↑ 33,0 33,1 Callen, H.B. (1960/1985), paĝo 84.
- ↑ 34,0 34,1 Adkins, C.J. (1975), paĝo 38.
- ↑ 35,0 35,1 Bailyn, M. (1994), paĝo 49.
- ↑ 36,0 36,1 Kondepudi, D. (2008), paĝo 180.
- ↑ 37,0 37,1 Kondepudi, D. (2008), paĝo 181.
- ↑ Gislason, E.A., Craig, N.C. (2005). Cementing the foundations of thermodynamics:comparison of system-based and surroundings-based definitions of work and heat, J. Chem. Thermodynamics 37: 954-966.
- ↑ Kondepudi, D. (2008), paĝo 63.
- ↑ Preston, T. (1894/1904). The Theory of Heat, second edition, revised by J.R. Cotter, Macmillan, London, paĝoj 700-701.
- ↑ Adkins, C.J. (1975), paĝo 45.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝo 134.
- ↑ Kondepudi, D. (2008), paĝo 64.
- ↑ 44,0 44,1 Adkins, C.J. (1975), paĝo 46.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝo 59.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝoj 52-53.
- ↑ Truesdell, C., Bharatha, S. (1977), paĝo 150.
- ↑ Callen, H.B. (1960/1985), paĝo 86.





























































![{\displaystyle \delta Q\ =\left[p(V,T)\,+\,\left.{\frac {\partial U}{\partial V}}\right|_{(V,T)}\right]\,\delta V\,+\,\left.{\frac {\partial U}{\partial T}}\right|_{(V,T)}\,\delta T}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f84955a4832939c4d1337fcfadae0affc3a945bc)








![{\displaystyle \delta Q\ =\left[\left.{\frac {\partial U}{\partial p}}\right|_{(p,T)}\,+\,p\left.{\frac {\partial V}{\partial p}}\right|_{(p,T)}\right]\delta p\,+\,\left[\left.{\frac {\partial U}{\partial T}}\right|_{(p,T)}\,+\,p\left.{\frac {\partial V}{\partial T}}\right|_{(p,T)}\right]\delta T}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c80e88197ed385fd3debc25941f418cec98cd244)















![{\displaystyle C_{p}(p,T)-C_{V}(V,T)=\left[p(V,T)\,+\,\left.{\frac {\partial U}{\partial V}}\right|_{(V,T)}\right]\,\left.{\frac {\partial V}{\partial T}}\right|_{(p,T)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e5046f626f9dccc1569d9c418d77d6cd6c0a06b)
