Sulfanilata acido
| Sulfanilata acido | |||
 | |||
Sulfanilata acido | |||
 | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 121-57-3 | ||
| ChemSpider kodo | 8166 | ||
| PubChem-kodo | 8479 | ||
| Merck Index | 15,9058 | ||
| Fizikaj proprecoj | |||
| Aspekto | blankaj aŭ helbrunaj kristaloj | ||
| Molmaso | 173,186 g mol−1 | ||
| Denseco | 1,485g/cm−3 | ||
| Fandpunkto | 288 °C [1] | ||
| Refrakta indico | 1,5567 | ||
| Acideco (pKa) | 3,24 °C [2] | ||
| Solvebleco | Akvo:10 g/L [3] | ||
| Mortiga dozo (LD50) | 12300 mg/kg (buŝe) [4] | ||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H315, H317, H319 | ||
| GHS Deklaroj pri antaŭgardoj | P280, P302+352, P305+351+338 | ||
(25 °C kaj 100 kPa) | |||
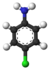
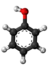
Sulfanilata acido estas organika kombinaĵo kun la formulo C6H5NH2SO3. Ĝi estas aminobenzenosulfonata acido kun anilino lokigita en la 4-a pozicio de la aromata ringo. Ĝi estas blanka aŭ helbruna solidaĵo, iomete solvebla en akvo kaj varma metanolo, sed nesolvebla en etanolo, duetila etero, benzeno, natria hidroksido kaj natria karbonato.
Sulfanilata acido estas uzata kiel reakciaĵo por detektado de la histidino per kromatografia metodo. Ĝi ankaŭ uzatas kiel kemia peraĵo en organikaj sintezoj kaj en la produktado de farmaciaĵoj. Laboratorie ĝi uzatas en la kvanta analizo de nitrataj kaj nitritaj jonoj (Reakcio de Griess). Ĝi plenumas esencan rolon en la manufakturado de duazo kolorigaĵoj (ekzemple: la metiloranĝo) kaj sintezoj de sulfaj drogoj (tiel kiel la sulfonamidoj).
Sulfanilata acido mem ne havas signifan efikon kontraŭ bakterioj, ĉar ĝi apenaŭ povas penetri la membranon de la mikroorganismoj pro sia alta poluseco. La solida acido ekzistas sub la zwiterjona formo kaj posedas nekutiman altan fandpunkton. Sulfanilata acido estas neakordigebla kun fortaj oksidigagentoj, fortaj acidoj kaj bazoj kaj fortaj reduktigagentoj. Per malkomponado ĝi ellasas karbonan unuoksidon, karbonan duoksidon, nitrogenajn kaj sulfurajn oksidojn.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado de sulfanilata acido per traktado de anilino kaj sulfata acido:
Sintezo 2[redakti | redakti fonton]
- Preparado de sulfanilata acido per traktado de sulfura trioksido kaj anilino:
Sintezo 3[redakti | redakti fonton]
- Preparado per reduktado de anilino kun sulfurila klorido en akva medio:
Sintezo 4[redakti | redakti fonton]
- Preparado de sulfanilata acido per traktado de kloroanilino kun natria sulfito:
Sintezo 5[redakti | redakti fonton]
- Preparado de sulfanilata acido per interagado de klorobenzeno kun sulfita acido sekvata per amonolizo de la benzenosulfonata acido:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Sapigo de la sulfanilata acido
Reakcio 2[redakti | redakti fonton]
- Esterigo de la sulfanilata acido:
Reakcio 3[redakti | redakti fonton]
- Preparado de sulfanilamido per amonolizo de la sulfanilata acido:





![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)



![{\displaystyle {\mathsf {{\xrightarrow[{-\;HCl}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9dba2fec3ed5be5edc819a4d2f1fa984d913593)


![{\displaystyle {\mathsf {{\xrightarrow[{}]{H_{2}SO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a91dd08456a5acd28298697e8e92c1123b59ed37)