Amonia arsenato
| Amonia arsenato | ||||

| ||||
| Kemia strukturo de la Amonia arsenato | ||||
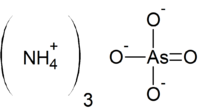
| ||||
| Kemia strukturo de la Amonia arsenato | ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 7784-44-3 | |||
| ChemSpider kodo | 22978 | |||
| Fizikaj proprecoj | ||||
| Aspekto | Senkoloraj kristaloj | |||
| Molmaso | 176 g mol−1 | |||
| Smiles | [O-][As]([O-])(=O) O.[NH4+].[NH4+] | |||
| Denseco |
| |||
| Solvebleco:Akvo | Solvebla | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H350, H331, H301, H410 | |||
| GHS Deklaroj pri antaŭgardoj | P262, P302, P303, P332, P333, P353, P360 | |||
Amonia arsenato aŭ (NH4)3AsO4 estas neorganika kombinaĵo kaj salo rezultanta el reakcio inter la amoniako kaj arsenata acido. Ĝi estas senkolora aŭ blanka kristalo, toksa per ingestado, tre solvebla en akvo kaj malkomponiĝas en varma akvo kun liberigo de amoniako. Ĉar ĝiaj solvaĵoj estas acidaj, ĝi neŭtraligas bazojn en reakcioj kie varmo generiĝas, tamen malpli aŭ tre malpli ol kiam generita de neŭtraligo fare de la neorganikaj acidoj, neorganikaj oksoacidoj kaj karboksilataj acidoj.
Ĝi estas alte toksa kaj povas esti fatala kiam inhalita, enspirita aŭ per haŭtokontakto. Efikoj pro kontakto aŭ inhalado povas longe daŭri. Fajro povas kaŭzi iritajn, korodajn kaj toksajn gasojn. Elversiĝo el fajrokontrolo aŭ arsena akvosolvaĵo povas esti koroda aŭ/kaj toksa kaj polui. La substanco ne estas bruliva, tamen ĝi malkomponiĝas per varmigo kaj produktas korodajn kaj toksajn fumojn. Ujoj povas eksplodi en la ĉeesto de varmo.
Sintezo[redakti | redakti fonton]
Reakcio inter saturita solvaĵo de amoniako kaj "arsenata acido":
Literaturo[redakti | redakti fonton]
- Chemical Book
- New Jersey Department of Health
- Pesticide Database
- Emergency Planning and Community RightToKnow Act section 313 reporting ...
- Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens ..., Volume 1
- Handbook of Emergency Chemical Management, David R. Quigley
| ||||||
Referencoj[redakti | redakti fonton]






