1,4-Dioksano
| Duetilenoduoksido | ||||
| Kemia formulo | ||||
 | ||||
Duetilenoduoksido | ||||
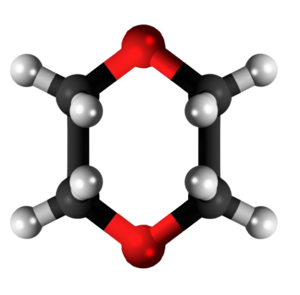 | ||||
| Alternativa(j) nomo(j) | ||||
| CAS-numero-kodo | 123-91-1 | |||
| ChemSpider kodo | 29015 | |||
| PubChem-kodo | 31275 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora likvaĵo, brulema, higroskopa kun etera odoro[1] | |||
| Molmaso | 88,10632 g mol−1 | |||
| Denseco | 1,033 g/cm−3[2] | |||
| Fandpunkto | 11,8 °C [3] 12 °C [4] | |||
| Bolpunkto | 101 °C [5][6] | |||
| Refrakta indico | 1,4042 | |||
| Ekflama temperaturo | 12,2 °C [7] | |||
| Solvebleco | Akvo:solvebla[8] Solvebla en acetono, benzeno, heptano, karbona tetraklorido, eteroj kaj plejmulto el la organikaj nepolaraj solvantoj. | |||
| Mortiga dozo (LD50) | 5200 mg/kg (buŝe) [9] | |||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H225, H319, H335, H350, H351 | |||
| GHS Deklaroj pri antaŭgardoj | P203, P210, P233, P240, P241, P242, P243, P261, P264+265, P271, P280, P303+361+353, P304+340, P305+351+338, P318, P319, P337+317, P370+378, P403+233, P403+235, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
1,4-Dioksano aŭ duetilenoduoksido estas organika kombinaĵo rezultanta per senhidratigado de la duetilena glikolo. Ĝi estas senkolora, brulema, higroskopa likvaĵo kun etera odoro, solvebla en akvo kaj solvebla en acetono, benzeno, heptano, karbona tetraklorido, eteroj kaj plejmulto el la organikaj nepolaraj solvantoj. 1,4-Dioksano posedas 4 karbonatomojn, 8 hidrogenatomojn kaj 2 oksigenatomojn. 1,4-Dioksano uzatas en kemiaj sintezoj kaj en la preparado de farmaciaĵoj kaj industriaĵoj.
Dioksano-vaporoj formas eksplodemajn miksaĵojn kun aero. En ĉeesto de lumo kaj oksigeno formiĝas hidroperoksidoj, kiuj estas malpli volatilaj ol dioksano mem kaj povas kaŭzi fortajn eksplodojn kiam distilataj. Dioksano estas suspektita kiel kancerogenaĵo. En bestaj eksperimentoj, oni observis pliiĝon de la efikoj aplikante 10 - 100 mg/kg tage post saturado de la normala metabolo de dioksano. En altaj koncentriĝoj ĝi ankaŭ agas sur la centra nervosistemo kaj kaŭzas renan damaĝon. Dioksano povas reagi perforte kun oksigenaj agentoj, litia aluminia hidrido kaj fortaj acidoj.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado de la 1,4-dioksano per senhidratigado de la duetilena glikolo:
Sintezo 2
[redakti | redakti fonton]- 1,4-dioksano povas prepariĝi ekde la oksirano:
Sintezo 3
[redakti | redakti fonton]- Preparado de la 1,4-dioksano per senhidratigado de la etilena glikolo:
Sintezo 4
[redakti | redakti fonton]- 1,4-dioksano povas prepariĝi ekde la acetaldehido:





![{\displaystyle {\mathsf {{\xrightarrow[{-\,H_{2}O}]{H_{2}SO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/296e232fdc8415bc7ccd734f252d799a7b796036)



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)

![{\displaystyle {\mathsf {{\xrightarrow[{-\,2\,H_{2}O}]{H_{2}SO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db381eaffd1eb079ab5bde9d88fae4026d5bdb44)