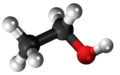
Acetono
| Acetono | ||||
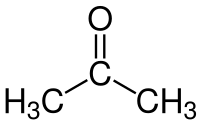 | ||||
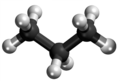
| Plata kemia strukturo de la Acetono | ||||
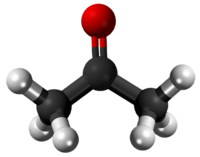 | ||||
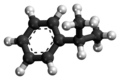
| Tridimensia strukturo de la Acetono | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 67-64-1 | |||
| ChemSpider kodo | 175 | |||
| PubChem-kodo | 180 | |||
| Merck Index | 14,66 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora likvaĵo kun forte irita odoro | |||
| Molmaso | 58.08 g·mol−1 | |||
| Denseco | 0.784 g cm−3 | |||
| Fandpunkto | −94.7 °C | |||
| Bolpunkto | 56 °C | |||
| Refrakta indico | 1,3588 | |||
| Ekflama temperaturo | −20 °C | |||
| Memsparka temperaturo | 465 °C | |||
| Acideco (pKa) | 19.2 | |||
| Acideco (pKb) | -5.2 | |||
| Solvebleco | Akvo:Tute miksebla kun akvo, benzeno, etero, metanolo, kloroformo kaj alkoholo | |||
| Mortiga dozo (LD50) | 3000 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Risko | R11 R23/24/25 R36 R39 R66 R67 | |||
| Sekureco | S7 S9 S16 S26 S37 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H225, H319, H336 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P261, P305+351+338 | |||
Acetono aŭ propanono aŭ dimetilketono estas senkolora likvaĵo, la plej simpla ketono CH3-CO-CH3. En normalaj kondiĉoj ĝi estas likvaĵo. Je normala atmosfera premo ĝi bolas je temperaturo de 56,2 °C. Ĝi miksiĝas kun akvo en ĉiu proporcio.
Historio
[redakti | redakti fonton]La acetono unue estis produktita de Andreas Libavius en 1606 per distilado de plumbo (II) acetato.
En 1832, franca apotekisto Jean-Baptiste Dumas kaj la germana apotekisto Justus von Liebig determinis la empirian formulon de la acetono. En 1833, francaj apotekistoj Antoine Bussy kaj Michel Chevreul decidis nomi acetonon aldonante la sufikson -ono al la radikalo de la ekvivalenta acido (t.e., acetata cido) ekzakte kiel simile al produkto kiu tiam estis konfuzita kun la margarata acido, la margarono.
Antaŭ 1852, angla apotekisto Alexander William Williamson ekkomprenis ke acetono estis unu metilacetilo;[34] la sekvan jaron, la franca apotekisto Charles Frédéric Gerhardt konfirmis. En 1865, la germana kemiisto August Kekulé publikigis la modernan strukturan formulon por acetono. Johann Josef Loschmidt prezentis la strukturon de acetono en 1861, sed lia private publikigita broŝuro ricevis nur malmulte da atento. Dum 1-a Mondmilito, Chaim Weizmann evoluigis la procezon por industria produktado de la acetono (Weizmann Process).
Produktado
[redakti | redakti fonton]En 2010, la tutmonda produktada-kapacito por acetono estis taksita je 6.7 milionoj da tunoj jare. Per 1,56 milionoj da tunoj jare, Usono havis la plej altan produktada-kapaciton, sekvitan de Tajvano kaj kontinenta Ĉinio. La plej granda produktanto de acetono estas la usona firmao INEOS Phenol, posedante 17% de la kapacito de la mondo, kun ankaŭ signifa kapacito (7-8%) de Mitsui, Sunoco kaj Shell en 2010.[40] INEOS Phenol ankaŭ posedas la plej grandan produktejon de la mondo (420,000 tunoj/jare) en Beveren (Belgio). La plej alta prezo de acetono en somero 2011 estis 1100–1250 USD/tuno en Usono.
Aktuala metodo Acetono estas produktita rekte aŭ nerekte el propeno. Ĉirkaŭ 83% de acetono estas produktitaj per la kumena procezo; kiel rezulto, acetona produktado estas ligita al fenola produktado. En la kumena procezo, benzeno estas alkiligata kun propileno por produkti kumenon, kiu estas oksigenita per aero por produkti fenolon kaj acetonon:
- Kumena procezo: Preparado de la acetono kaj fenolo per traktado de benzeno kaj propileno:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de la acetono per kalcinigo de la baria acetato:
Reakcio 2
[redakti | redakti fonton]- Preparado de la propanamido per traktado de propanono kaj hidroksilamino en ĉeesto de fosfora triklorido kaj akompanata per molekula rearanĝo ankaŭ konata kiel Transigo de Beckmann:
Reakcio 3
[redakti | redakti fonton]- Reduktigo de Clemmensen: Preparado de la etano per traktado de propanono kaj klorida acido:
Reakcio 4
[redakti | redakti fonton]- Reakcio de Wolff-Kishner: Preparado de la etano per traktado de propanono kaj hidrazino:
Reakcio 5
[redakti | redakti fonton]- Oksidigo de ketonoj (KMnO4): Preparado de la acetata acido per traktado de propanono kaj kalia permanganato:
Sintezo 6
[redakti | redakti fonton]- Preparado de la acetona cianhidrino per traktado de propanono kaj cianida acido:
Sintezo 7
[redakti | redakti fonton]- Preparado de la propanono per traktado de acetileno kaj sodamido, sekvata per interagado de natria acetilido kaj metila jodido. La tria parto konsistas je hidratigado de la propino formita en acida medio:
Sintezo 8
[redakti | redakti fonton]- Preparado de la propanono per kataliza hidratigo de la etanolo :[1]
Kombinaĵoj
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]Eksteraj ligiloj
[redakti | redakti fonton]- http://daneshnameh.roshd.ir/mavara/mavara-index.php?page=%D8%A7%D8%B3%D8%AA%D9%88%D9%86 Arkivigite je 2006-05-13 per la retarkivo Wayback Machine (perse)
- http://www.notes.co.il/ben-hateva/11137.asp Arkivigite je 2005-11-30 per la retarkivo Wayback Machine (hebree)
- http://www.chemnet.com.tw/magazine/200302/index12.htm Arkivigite je 2006-01-11 per la retarkivo Wayback Machine (ĉine)
- http://www.ilo.org/public/english/protection/safework/cis/products/icsc/dtasht/_icsc00/icsc0087.htm angle








![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)
![{\displaystyle {\mathsf {{\xrightarrow[{}]{KMnO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dfb7bf7200ad1ff303913ea91a8a635c60a816c0)





![{\displaystyle {\mathsf {{\xrightarrow[{-\,H_{2}O}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a949d6c5dc335f05446fa6b91ee515dab725322d)

![{\displaystyle {\mathsf {{\xrightarrow[{-\,H_{3}PO_{3}}]{+\,PCl_{3}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19ac76783a8943a6dcc0c12b460a49f864f52b74)













![{\displaystyle {\mathsf {{\xrightarrow[{-\,NH_{3}}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ebe9d78b9ce82356a31126eded5a85c401510a3)

![{\displaystyle {\mathsf {{\xrightarrow[{-\,NaI}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/91746d2516561ad569fc0b87ca9f6dcfe6691272)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{+\,H_{2}O}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f47315ea1282abce681df0aba629f09eafbd56b)