Cianogena fluorido
| Cianogena fluorido | |||
 | |||
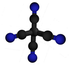
| Plata kemia strukturo de la Cianogena fluorido | |||
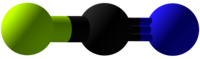 | |||
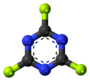
| Tridimensia kemia strukturo de la Cianogena fluorido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 1495-50-7 | ||
| ChemSpider kodo | 120749 | ||
| PubChem-kodo | 137036 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora, toksa, koroda, larmiga gaso | ||
| Molmaso | 45,0158 g·mol-1 | ||
| Denseco | 1,975g cm−3 | ||
| Fandpunkto | -82°C[1] | ||
| Bolpunkto | -46°C | ||
| Solvebleco | Akvo:Nesolvebla | ||
| Mortiga dozo (LD50) | 6 mg/kg (buŝe)[2] | ||
| Sekurecaj Indikoj | |||
| Riskoj | R24 R28 | ||
| Sekureco | S1/2 S36/37 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H300, H310, H330, H361, H371 | ||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P260, P262, P264, P270, P271, P280, P281, P284, P301+310, P304+340, P310, P320, P321, P330, P361, P363, P403+233, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Cianogena fluorido aŭ C≡NF estas neorganika fluora kombinaĵo de karbono kaj nitrogeno, senkolora, toksa, koroda, larmiga gaso kun lineara strukturo, uzata en kemiaj sintezoj kaj kiel reakciaĵo en laboratorioj. Cianogena fluorido estas uzata por degradigo de alkaloidoj, cianatigo de aromataj derivaĵoj krom aliaj reakciaĵoj.
Cianogena fluorido, unue identigita en 1931 sed ne izolita ĝis 1964, estas la malpli esplorita el la kvar cianogenaj halogenidoj.[3] Unumera cianogena fluorido estas plej bone preparata per pirolizo sub alta temperaturo kaj reduktata premo de la cianurata fluorido (vidu reakcion 1).
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per pirolizo de la cianurata fluorido:[4]
Sintezo 2[redakti | redakti fonton]
- Preparado per traktado de nitrogena trifluorido kaj cianogeno:
Sintezo 3[redakti | redakti fonton]
Sintezo 4[redakti | redakti fonton]
- Preparado per agado de karbona kvarcianido sur cezia fluorido:
Sintezo 5[redakti | redakti fonton]
- Preparado per traktado de kalia kvarcianozinkato kaj kloro:
Sintezo 6[redakti | redakti fonton]
- Preparado per interagado de natria cianido kaj kloro:
Sintezo 7[redakti | redakti fonton]
- Preparado ekde la cianogena bromido:
Sintezo 8[redakti | redakti fonton]
- Preparado ekde la cianogena jodido:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Trimerizo de la cianogena fluorido:
Reakcio 2[redakti | redakti fonton]
- Reakcio kun natrio:
Reakcio 3[redakti | redakti fonton]
- Reakcio kun sulfura trioksido:
Reakcio 4[redakti | redakti fonton]
- Reakcio kun natria hidroksido:
Reakcio 5[redakti | redakti fonton]
- Hidrolizo de la cianogena fluorido:
Reakcio 6[redakti | redakti fonton]
- Hidrolizo de la cianogena fluorido per 2 molumoj da akvo:
Reakcio 7[redakti | redakti fonton]
- Reakcio kun amoniako:
Reakcio 8[redakti | redakti fonton]
- Reakcio kun etilmagnezia fluorido:
Reakcio 9[redakti | redakti fonton]
- Reakcio kun benzeno:
Reakcio 10[redakti | redakti fonton]
- Preparado de benzonitrilo:
Literaturo[redakti | redakti fonton]
- ACS Publications
- Catalog of National Bureau of Standards Publications
- Fluorine Chemistry at the Millennium: Fascinated by Fluorine
- Chemical Warfare Agents: Toxicology and Treatment
- Inorganic Chemistry
- Academic Press Dictionary of Science and Technology





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)