Taliuma (III) klorido
| Taliumika muriato | ||||
| Kemia formulo | ||||
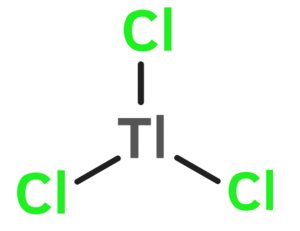 | ||||
Taliumika klorido | ||||
 | ||||
 | ||||
| Kristala strukturo de la taliumika klorido. | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| CAS-numero-kodo | 13453-32-2 | |||
| ChemSpider kodo | 2341253 | |||
| PubChem-kodo | 83482 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora aŭ flaveca, lumsensiva kaj ne-higroskopa ortoromba kristalo | |||
| Molmaso | 310,73g mol−1 | |||
| Denseco | 4,7 g/cm−3 | |||
| Fandpunkto | 37°C [1] | |||
| Bolpunkto | 177°C | |||
| Ekflama temperaturo | Ne brulema | |||
| Solvebleco | Akvo:862 g/L[2] Solvebla en en pluraj organikaj solvaĵoj tia kia dumetilsulfoksido, kaj nesolvebla en acetono, piridino, benzeno kaj nitrobenzeno. | |||
| Mortiga dozo (LD50) | >2000 mg/kg (buŝe) | |||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H300, H330, H373, H411 | |||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P270, P271, P273, P284, P301+316, P304+340, P316, P319, P320, P321, P330, P391, P403+233, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
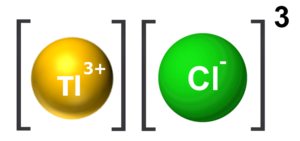
Taliuma (III) klorido aŭ trikloro-taliumo estas neorganika kombinaĵo apartenanta al la familio de la kloridoj, rezultanta el interagado de la taliuma (III) hidroksido kaj klorida acido. Taliuma (III) klorido estas solvebla en akvo, iomete solvebla en dumetilsulfoksido, kaj nesolvebla en acetono, piridino, benzeno kaj nitrobenzeno. Taliuma (III) klorido prezentas tri klorajn jonojn ligitajn al taliumatomo. Ĝi konsistas je 1 taliumatomo, 3 kloratomoj, kaj uzatas en kemiaj sintezoj.
La komerce disponebla materialo estas la blanka tetrahidrato, kiu estas la formo akirita per vaporiĝo de akvaj solvaĵoj de taliuma (III) klorido. Pri parta senhidratigo en vakua elsekigilo ĉe media temperaturo, ĝi formas likvaĵon kiu iĝas kovrita per krusto, malhelpante pluan perdon de akvo. Fine oni akiras monohidraton. Malgraŭ raporto, ke daŭra senhidratiĝo neeviteble rezultigas perdon de kloro, ekzistas tri raportoj pri la preparado de anhidra taliuma (III) klorido, kun kontentiga analizo, pri longedaŭra elsekiĝo. Alternative, estas postulite ke la hidrato povas konvertiĝi al la anhidra salo per traktado kun tionila klorido aŭ karbonila klorido.
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Preparado de taliuma (III) klorido per traktado de taliuma (III) hidroksido kun klorida acido
Reakcio 2[redakti | redakti fonton]
- Preparado de taliuma (III) klorido per traktado de klorida acido kun taliuma (III) karbonato:
Reakcio 3[redakti | redakti fonton]
- Preparado de taliuma (III) klorido per traktado de baria klorido kun taliuma (III) sulfato:
Reakcio 4[redakti | redakti fonton]
- Preparado de taliuma (III) klorido per traktado de kloro kun taliumo:
Reakcio 5[redakti | redakti fonton]
- Preparado de taliuma (III) klorido per traktado de klorida acido kun taliumo:





![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)








![{\displaystyle {\mathsf {{\xrightarrow[{}]{-H_{2}O}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4187ae7f7f0f64f704fe0ca976614933bfe3a46)