Piridino
| Piridino | |||
| |||
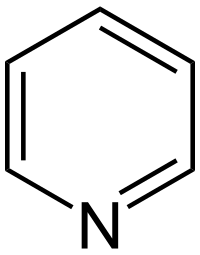
| Planaj kemiaj strukturoj de la Piridino | |||

| |||
| Du- kaj tri-dimensiaj strukturoj de la Piridino | |||
| Alternativa(j) nomo(j) | |||
| Kemia formulo | |||
| CAS-numero-kodo | 110-86-1 | ||
| ChemSpider kodo | 1020 | ||
| PubChem-kodo | 1049 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora ĝis flaveca likvaĵo | ||
| Molmaso | 79.10 g mol-1 | ||
| Denseco | 0.9819 g/cm3 | ||
| Fandopunkto | −41.6 °C (−42.9 ℉; 231.6 K) | ||
| Bolpunkto | 115.2 °C (239.4 ℉; 388.3 K) | ||
| Ekflama temperaturo | 21 °C | ||
| Refrakta indico | 1,509 | ||
| Solvebleco | Akvo:Tute miksebla | ||
| Sekurecaj Indikoj | |||
| Risko | R20 R21 R22 R34 R36 R38 | ||
| Sekureco | S(2) S26 S28 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj[1] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H302, H315, H319, H401 | ||
| GHS Deklaroj pri antaŭgardoj | P264, P270, P273, P280, P301+312, P302+352, P305+351+338, P330, P332+313, P337+313, P362, P501 | ||
(25 °C kaj 100 kPa) | |||
Piridino estas heterocikla aromata kemia kombinaĵo apartenanta al la grupo de la azinoj, je media temperaturo ĝi prezentiĝas kiel likvaĵo senkolora, alte bruligebla, malforte alkala kun karakteriza malagrabla odoro. La piridino estiĝas per sintezo ekde la acetaldehido kaj amoniako aŭ per karbondistilado.
La piridino posedas malfortan bazecon povante formi salojn kun acidoj. Ĝia plej grava propreco, profitata de la vivaj organismoj uzantaj kombinaĵoj de piridino, estas la ebleco interagi en la oksi-reduktajn reakciojn, estigante ligaĵojn kun la hidrogeno de la Nikotinamida Adenina Dinukleotido, tiele agante kiel "transportanto de elektronoj". Komponaĵoj rilatitaj al la piridino estiĝas reakciante 1,5 ketonoj kun amonia nitrato meze de acetata acido aŭ ekde la nikotinata acido, ankaŭ konata kiel niacino.[2]
Historio[redakti | redakti fonton]
Piridino malkovriĝis de la skota kemiisto Thomas Anderson (1819-1874)[3] en 1849[4], kiel unu el la konstituantoj de la ostoleo[5]. Post du jaroj, Andersono izolis puran piridinon per frakcia distilado de la oleo.
Piridino estas kruda materialo kaj antaŭanto por sennombraj agrikulturaj kaj farmaciaj kemiaĵoj kaj ankaŭ grava solvanto kaj reakcianto. Piridino aldoniĝas al etanolo por igi ĝin maltaŭga por drinkado. Ĝi same uzatas kiel invitra sintezo por la DNA, en la sintezo de la sulfopiridino, -- kiu estas drogo uzatas kontraŭ bakteriaj kaj virusaj infektiĝoj --, antihistaminaj drogoj, tripelennamino -- drogo uzata kiel kontraŭjuka kaj unua-generacia antihistaminoj --, samkiel akvo forpeliloj, baktericidoj, kaj herbicidoj.
Kelkaj kemiaj kombinaĵoj, kvankam ne sintezitaj rekte el la piridino, enhavas ties ringan strukturon. Inter ili troviĝas la B-vitaminoj niacino kaj piridoksalo, la kontraŭtuberkuloza drogo izoniazido, nikotino kaj aliaj nitrogenhavaj plantaj produktoj. Historie piridino produktiĝis el la terkarbo kiel kromprodukto de la karbogasigado. Tamen, altaj konsumoj por piridino rezultis en disvolviĝo de pli ekonomiaj sintezaj metodoj ekde la acetaldehido kaj la amoniako, kaj en la tuta mondo pli ol dudek mil tunoj da piridinoj produktiĝas ĉiujare.
Aleksej Ĉiĉibabin (1871-1945) estis rusa kemiisto kiu unue malkovris la metodon pri sintezado de kemiaĵoj surbaze de la piridinaj ringoj.[6]
Historiaj sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- En 1877, William Ramsay (1852-1816), sekvante la rezonkapablon de Marcellin Berthelot (1827-1907), rilate al la sintezo de la benzeno ekde la acetileno, uzis miksaĵon de acetileno kaj cianida acido tra ruĝo-varma tubo kaj produktis malgrandajn kvantojn da piridino:
Sintezo 2[redakti | redakti fonton]
- En 1879, Wilhelm Koenigs (1851–1906) estis bonsukcesa kiam li produktis iom da piridino per distilado de etil-alil-amino sur varmega litargo[7]:
Sintezo 3[redakti | redakti fonton]
- En 1885, Max Dennstedt (1852–1931) kaj Heinrich Zimmermann (1846–1899) faris eksperimentojn por produktado de piridino pere de interagado inter pirolo, metilena dujodido kaj metokso-natrio:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
Reakcio 2[redakti | redakti fonton]
- Metala natrio forigas hidrogenatomon el la molekulo de la piridino, kaj dupiridilo, ankaŭ konata kiel dupiridino, estiĝas per ligado de la du molekuloj:
Reakcio 3[redakti | redakti fonton]
- Piridino reakcias kun bromo por doni bromo-piridinon:
Vidu ankaŭ[redakti | redakti fonton]
-
α-Pikolino -
β-Pikolino -
γ-Pikolino -
Piridoksalo aŭ Vitamino B6 -
Niacino aŭ Vitamino B3 -
Sulfapiridino -
Tripelennamino -
Izoniazido -
Nikotino -
p-toluidino
Referencoj[redakti | redakti fonton]
- ↑ LabChem. Arkivita el la originalo je 2016-10-20. Alirita 2017-06-17.
- ↑ Pyridines: from lab to production, Eric F.V. Scriven
- ↑ Industrial Aromatic Chemistry: Raw Materials · Processes · Products, Heinz-Gerhard Franck, Jürgen W. Stadelhofer
- ↑ TheInfoList.com
- ↑ Oleo de Dippel aŭ ostoleo estas nitrogena rezidua produkto de la detruiga osta distiliĝo. Ĝi estas viskoza malhela likvaĵo kun malagrabla odoro, malkovrita de Johann Konrad Dippel (1673-1734).
- ↑ Nitrogenation Strategy for the Synthesis of N-containing Compounds, Ning Jiao
- ↑ Litargo estas antikva kemia alnomo por plumba oksido.






![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)


![{\displaystyle {\mathsf {{\xrightarrow[{-3Pb}]{+3\,PbO}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c98affbea1fe7fa805a9b867f90c70ebc7773e1)

![{\displaystyle {\mathsf {{\xrightarrow[{varmo}]{LiAlH_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0abcb61ff2bdf098eb43b7e78f3972f26a5fb4bd)
![{\displaystyle {\mathsf {{\xrightarrow[{natrio}]{metala}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4d46ef71c8d9500e98ce5c539e8a3aa964fa9638)