Cianogena jodido
| Cianogena jodido | ||||
 | ||||
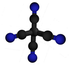
| Plata kemia strukturo de la Cianogena jodido | ||||
 | ||||
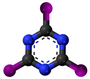
| Tridimensia kemia strukturo de la Cianogena jodido | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 506-78-5 | |||
| ChemSpider kodo | 10046 | |||
| PubChem-kodo | 10478 | |||
| Merck Index | 15,2685 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkoloraj aŭ rozkoloraj, toksaj, korodaj kristaloj kun tranĉa odoro kaj kaŭstika gusto | |||
| Molmaso | 152,922 g·mol-1 | |||
| Denseco | 2,840g cm−3[1] | |||
| Fandpunkto | 146,7°C[2] | |||
| Bolpunkto | 154°C | |||
| Solvebleco | Akvo:reakcias | |||
| Mortiga dozo (LD50) | 18 mg/kg (buŝe)[3] | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R26 R27 R28 R32 | |||
| Sekureco | S1/2 S7 S28 S29 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H301, H311, H315, H319, H331, H335 | |||
| GHS Deklaroj pri antaŭgardoj | P261, P264, P270, P271, P280, P301+310, P302+352, P304+340, P305+351+338, P311, P321, P330, P332+313, P337+313, P361, P362, P363, P403+233, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
Cianogena jodido aŭ N≡CI estas neorganika joda komponaĵo de karbono kaj cianido, senkoloraj aŭ rozkoloraj, toksaj, korodaj kristaloj kun tranĉa odoro, uzata en kemiaj sintezoj kaj kiel analiza reakciaĵo.
Ĝi estas stabila substanco sed lumsensiva. Ĝi estas neakordigebla kun fortaj acidoj, fortaj bazoj kaj fortaj oksidigagentoj. Cianogena malkomponiĝas ĉe kontakto kun acidoj, bazoj, amoniako kaj alkoholoj kaj sub varmigo ĝi produktas toksajn gasojn inklude de cianida acido kaj jodida acido.
Ĝi reakcias kun karbona duoksido kaj malrapide kun akvo formante cianidan acidon. Jodido de cianogeno estas polara komponaĵo sed en ĉeesto de piridino ĝi konduktas elektran kurenton. Diluitaj solvaĵoj de cianogena jodido en piridino komence estas senkoloraj, tamen dum stokigo ĝi iĝas flava, oranĝokolora, ruĝo-bruna kaj forte ruĝo-bruna.
La efiko okazas pro modifo en la konduktiveco, kiu siavice rezultas pro formado de la elektrolito. Eksperimentoj elmontras ke cianidoj estas pli malfortaj saloj en piridino ol jodidoj, kvankam solvaĵoj de cianogena jodido plialtigas la elektran konduktivecon laŭmezure kiel ili maljuniĝas.
Cianogena jodido estis unue sintezita en 1824 de la franca kemiisto Georges-Simon Serullas (1774-1832)[4][5]. Cianogena jodido estis konsiderita unu el la nepuraĵoj de la komerce vendita jodo antaŭ la jardeko 1930.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per varma malkomponado de cianurata jodido:
Sintezo 2[redakti | redakti fonton]
- Preparado per traktado de nitrogena trijodido kaj cianogeno:
Sintezo 3[redakti | redakti fonton]
Sintezo 4[redakti | redakti fonton]
- Preparado per agado de karbona kvarcianido sur cezia jodido:
Sintezo 5[redakti | redakti fonton]
- Preparado per traktado de kalia kvarcianozinkato kaj jodo:
Sintezo 6[redakti | redakti fonton]
- Preparado per interagado de natria cianido kaj jodo:
Sintezo 7[redakti | redakti fonton]
- Preparado ekde la cianogena jodido:
Sintezo 8[redakti | redakti fonton]
- Preparado per traktado de kalia tiocianato kaj jodo en akva medio:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Trimerizo de la cianogena jodido:
Reakcio 2[redakti | redakti fonton]
- Reakcio kun natrio:
Reakcio 3[redakti | redakti fonton]
- Reakcio kun sulfura trioksido:
Reakcio 4[redakti | redakti fonton]
- Reakcio kun natria hidroksido:
Reakcio 5[redakti | redakti fonton]
- Hidrolizo de la cianogena jodido:
Reakcio 6[redakti | redakti fonton]
- Hidrolizo de la cianogena jodido per 2 molumoj da akvo:
Reakcio 7[redakti | redakti fonton]
- Reakcio kun amoniako:
Reakcio 8[redakti | redakti fonton]
- Reakcio kun etilmagnezia jodido:
Reakcio 9[redakti | redakti fonton]
- Reakcio kun benzeno:
Reakcio 10[redakti | redakti fonton]
- Preparado de benzonitrilo:
Reakcio 11[redakti | redakti fonton]
- Preparado de kalia tiocianato:[6]
Literaturo[redakti | redakti fonton]
- Hazardous Chemicals: Safety Management and Global Regulations
- Best Synthetic Methods: Organophosphorus (V) Chemistry
- Journal of the Chemical Society
- A System of Chemistry of Inorganic Bodies
- Crucibles: The Story of Chemistry from Ancient Alchemy to Nuclear Fission
- Handbook of Preservatives






![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)