Hidrazino
| Hidrazino | |||||
 | |||||
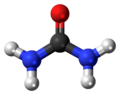
| Bastona kemia strukturo de la Hidrazino | |||||
 | |||||
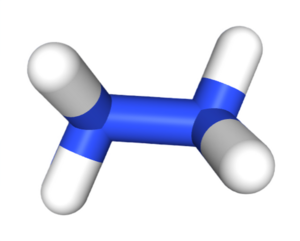
| Tridimensia kemia strukturo de la Hidrazino | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 302-01-2 | ||||
| ChemSpider kodo | 8960 | ||||
| PubChem-kodo | 9321 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora fumiganta likvaĵo | ||||
| Molmaso | 32.0452 g·mol−1 | ||||
| Denseco | 1.021g cm−3 | ||||
| Fandpunkto | 2 °C | ||||
| Bolpunkto | 114 °C | ||||
| Refrakta indico | 1,47 | ||||
| Ekflama temperaturo | 37 °C[1] | ||||
| Acideco (pKa) | 8.10 | ||||
| Solvebleco | Akvo:Tute solvebla | ||||
| Mortiga dozo (LD50) | 59 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R45 R10 R23/24/25 R34 R43 R35 | ||||
| Sekureco | S53 S45 S60 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H226, H300, H301, H301, H311, H314, H317, H330, H331, H350, H400, H410 | ||||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P272, P273, P280, P281, P284, P301+310, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P308+313, P310, P311, P312, P320, P321[2] | ||||
(25 °C kaj 100 kPa) | |||||
La Hidrazino aŭ Duazano estas neorganika komponaĵo kies molekula formulo estas N2H4. Ĝi estas senkolora bruligebla likvaĵo kun amoniakosimila odoro. Hidrazino estas alte toksa kaj substanco kaj danĝere malstabila escepte se manipulita en solvaĵo. Ĉirkaŭ la jaro 2000, proksimume 120 mil tunoj da hidrazinhidrato estis jare produktitaj en la tuta mondo, kio peze egalvolaras al 64% de akva hidrazinsolvaĵo.
Hidrazino estas ĉefe uzata kiel ŝaŭmiga agento en la preparado de polimeraj ŝaŭmoj, tamen ĝi ankaŭ uzatas kiel antaŭiloj de polimerizaj kataliziloj kaj farmaciaĵoj. Krom tio, la hidrazino uzatas kiel porraketa brulaĵo, kaj por prepari la gasgeneraĵojn uzatajn en la protektaj aerkusenoj. Hidrazino ankaŭ uzatas en la vaporcikloj de la Elektrostacioj nukleaj kaj konvenciaj kiel oksigenkonsumilo por kontroli la dissolvitan oksigenon kiel klopodo por redukti la korodan procezon, laŭ la ekvacio:
Ĝi ankaŭ uzatas kiel ĵetpafanto de artefaritaj satelitoj.
Sintezo[redakti | redakti fonton]
La hidrazinoj estas reakciproduktoj inter du aminoj primaraj aŭ sekundaraj.
Sintezo kaj fabrikiĝo[redakti | redakti fonton]
Theodor Curtius (1857-1928) unue sintezis la hidrazinon, en 1889, per tre malfacila procezo. Emil Fischer kojnis la vorton en 1875. Sed la pura anhidra hidrazino estis preparita de la nederlanda kemiisto Lobry de Bruyn, en 1895. La hidrazino ankaŭ produktiĝas en la Procezo Olin-Raschig de Natria hipoklorito (la aktiva agento en multaj blankigiloj) kun amoniako, kies procezon li anoncis en 1907. Ĉi-metodo sin bazas sur la reakcio de la kloramino kun amoniako.
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Preparado de hidrazino per traktado de kloramino kun amoniako
Reakcio 2[redakti | redakti fonton]
- Preparado de hidrazino per traktado de natria hipoklorito kun ureo:
Reakcio 3[redakti | redakti fonton]
- Preparado de hidrazino per traktado de ureo kun natria hipoklorito
Reakcio 4[redakti | redakti fonton]
- Alia laboratoria maniero produkti la hidrazinon estas per interagado de amoniako kun natria hipoklorito:
Vidu ankaŭ[redakti | redakti fonton]
Literaturo[redakti | redakti fonton]
- Universitato de Princeton Arkivigite je 2014-10-10 per la retarkivo Wayback Machine
- Encyclopedia Astronautica
- Encyclopedia Britannica
- 1911 Encyclopedia Britannica
- New World Encyclopedia








![{\displaystyle {\mathsf {{\xrightarrow[{}]{katalizilo}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ac4118b3002b6c715bec976e5427c4440185f3c)



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)