Tionila tetrafluorido
Aspekto
| Tionila tetrafluorido | |||
 | |||
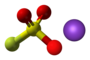
| Plata kemia strukturo de la Tionila tetrafluorido | |||
 | |||
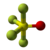
| Tridimensia kemia strukturo de la Tionila tetrafluorido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 13709-54-1 | ||
| ChemSpider kodo | 123077 | ||
| PubChem-kodo | 139557 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora gaso | ||
| Molmaso | 124,053 g·mol−1 | ||
| Denseco | 1,653g cm−3 | ||
| Fandpunkto | -99,6 °C | ||
| Bolpunkto | -49 °C | ||
| Solvebleco | Akvo:reakcias | ||
| Mortiga dozo (LD50) | 280 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R36/37/38 | ||
| Sekureco | S36/37 S38 S45 S63 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H300, H310, H314, H330 | ||
| GHS Deklaroj pri antaŭgardoj | P260, P262, P264, P270, P271, P280, P284, P301+310, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P330, P361, P363, P403+233, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Tionila tetrafluorido aŭ SOF4 estas neorganika fluora komponaĵo de sulfuro kaj oksigeno, senkolora, toksa gaso uzata kiel pesticido kaj reakcianto en kemiaj sintezoj. Tionila tetrafluorido forte reakcias kun akvo formante fluoridan acidon, fluorosulfonatan acidon kaj tionilan fluoridon. SOF4 estis unue sintezita en 1902 de la francaj kemiistoj Henri Moissan (1852-1907) kaj Paul Lebeau (1868-1959). La substanco estis preparita kaj studita en laboratorio en 1937 de la germana kemiisto Otto Ruff (1871-1939) sed la malkovro nur estis publikigita post la 2-a Mondmilito.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per traktado de tionila fluorido kaj fluoro en ĉeesto de plateno kiel katalizilo:[1]
Sintezo 2
[redakti | redakti fonton]- Preparado per interagado de tionila fluorido kaj arĝenta (II) fluorido
Sintezo 3
[redakti | redakti fonton]- Preparado per reakcio inter tionila fluorido kaj fluorida acido:
Sintezo 4
[redakti | redakti fonton]- Preparado per agado de sulfura heksafluorido sur oksigeno:
Sintezo 5
[redakti | redakti fonton]- Sintezo per malkomponado de tionila fluorido:
Sintezo 6
[redakti | redakti fonton]- Per agado de tionila fluorido sur fluorida acido:
Sintezo 7
[redakti | redakti fonton]- Per agado de sulfura tetrafluorido kaj sulfura trioksido:
Sintezo 8
[redakti | redakti fonton]- Per oksidigo de sulfura tetrafluorido kun nitrogena duoksido:
Sintezo 9
[redakti | redakti fonton]- Per oksidigo de sulfura tetrafluorido kun karbona dioksido:
Sintezo 10
[redakti | redakti fonton]- Per interagado de sulfura dioksido kun fluoro:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Malkomponado de tionila tetrafluorido:
Reakcio 2
[redakti | redakti fonton]- Hidrolizo de tionila tetrafluorido:
Reakcio 3
[redakti | redakti fonton]Reakcio 4
[redakti | redakti fonton]- Reakcio kun natria hidroksido:
Literaturo
[redakti | redakti fonton]- Pharmacology of Fluorides
- Inorganic Chemistry of the Main-Group Elements
- Handbook of Preparative Inorganic Chemistry
- Advances in Inorganic Chemistry
- The Chemistry of Fluorine and Its Compounds
- Methodicum Chimicum
Referencoj
[redakti | redakti fonton]- ↑ Emeléus H. J., Sharpe A. G.. (1960) Advances in inorganic chemistry and radiochemistry. Volume 2. Nov-Jorko: Academic Press, p. 117. ISBN 978-0-08-057851-4. OCLC 277088994.
- ↑ Advances in Inorganic Chemistry and Radiochemistry






![{\displaystyle {\mathsf {{\xrightarrow[{Pt}]{150^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a07d284b4027f5f16b58f453abfab2f0c61ba9bd)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{200^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5f5f5c5234bc268f3432dc2ee38eb16d773ee5a)

![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)