Dinitrogena pentoksido
| Dinitrogena pentoksido | |||||
 | |||||
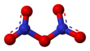
| Plata kemia strukturo de dinitrogena pentoksido | |||||
 | |||||
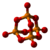
| Tridimensia kemia strukturo de dinitrogena pentoksido | |||||
| Kemia formulo | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| CAS-numero-kodo | 10102-03-1 | ||||
| ChemSpider kodo | 59627 | ||||
| PubChem-kodo | 66242 | ||||
| Merck Index | 15,6692 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | toksa, koroda, irita, brulema, blanka aŭ palflava solidaĵo | ||||
| Molmaso | 108,009 g·mol−1 | ||||
| Denseco | 1,642g cm−3 | ||||
| Fandpunkto | 30 °C[1] | ||||
| Bolpunkto | 32,5 °C | ||||
| Solvebleco | Akvo:reakcias | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R26 R34 | ||||
| Sekureco | S1/2 S9 S26 S28 S36/37/39 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H270, H280, H310+330, H310, H314, H330 | ||||
| GHS Deklaroj pri antaŭgardoj | P220, P244, P260, P262, P264, P270, P271, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P361, P363, P370+376, P403, P403+233, P405, P410+403, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Dinitrogena pentoksido, t.e. dunitrogena kvinoksido, (molekula formulo N2O5) estas neorganika nitrogena kombinaĵo de oksigeno, toksa, koroda, irita, brulema, blanka aŭ palflava solidaĵo, solvebla en kloroformo, klorhavaj solvantoj, nitrometano, trikloroacetata acido, karbona duoksido, acetono kaj malmulte solvebla en karbona kvarklorido. Laboratorial esploroj elmontris ke dunitrogena kvinoksido estas tiel irita substanco kiel la fosgeno kun similaj proprecoj rilate al sankondiĉoj.
La polareco de la solvantoj posedas signifan efikon sur la rapido de malkomponado en solvaĵo. Do la malkomponado-rapido estas pli forta en nepolaraj solvantoj kiel kloroformo kaj malpli forta en polaraj solvantoj kiel nitrometano. La malkomponado-rapido por solvaĵoj de dunitrogena kvinoksido en nitrata acido estas tre malforta kaj ĉi-solvaĵoj estas modere stabilaj sub mediaj temperaturoj.
Estante anhidrido de nitrata acido, dunitrogena kvinoksido facile reakcias kun humideco por formi nitratan acidon. En solida stato, dunitrogena kvinoksido estas jona substanco, ekzistanta kiel jonoj NO2+NO3- kaj kelfoje nomata nitrila nitrato. La samo okazas kun dunitrogena kvinoksido en polaraj solvantoj kiel nitrata acido kie kompleta jonigo al nitrila kaj nitrata jonoj observatas. Ĉi-komplekseco je konduto kaj en la fizika stato kaj en solvaĵo signifas ke ne alia nitrogenigagento estas tiel diversa kaj multcela kiel dinitrogena pentoksido.[2]
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- N2O5 estis unue sintezita en jaro 1840 de la franca kemiisto Henri Deville (1818-1881) kiu preparis ĝin per traktado de arĝenta (I) nitrato kaj kloro.
Sintezo 2[redakti | redakti fonton]
- Per interagado de fosfora kvinoksido kaj eksceso de nitrata acido:
Sintezo 3[redakti | redakti fonton]
- Per interagado de fosfora kvinoksido kaj kvar molumoj da nitrata acido:
Sintezo 4[redakti | redakti fonton]
- Per traktado de nitrogena dioksido kun ozono:[3]
Sintezo 5[redakti | redakti fonton]
- Per varma malkomponado de plumba (II) nitrato:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Kvankam dinitrogena pentoksido spontanee malkomponiĝas en nitrogena dioksido kaj oksigeno ĝi estabiliĝas en ĉeesto de ozono.
Reakcio 2[redakti | redakti fonton]
- Hidrolizo de dinitrogena pentoksido:
Reakcio 3[redakti | redakti fonton]
- Preparado de nitrobenzeno. En normalaj kondiĉoj benzeno ne reakcias kun N2O5 sed reakcias eksplode kun N2O5 en solida stato:[4]
Reakcio 4[redakti | redakti fonton]
- Preparado de nitrometano:
Reakcio 5[redakti | redakti fonton]
- Kiel nitrata anhidrido, dinitrogena pentoksido donas nitratojn en akva solvaĵo:
Reakcio 6[redakti | redakti fonton]
- Sintezo de nitrozila klorido:
Reakcio 7[redakti | redakti fonton]
- Kiel forta oksidanto, tiel N2O5 oksidigas sulfuran dioksidon al sulfura trioksido:
Reakcio 8[redakti | redakti fonton]
- Preparado de nitrila perklorato:
Reakcio 9[redakti | redakti fonton]
- N2O5 oksidigas hidrazinon al elementaj substancoj:
Reakcio 10[redakti | redakti fonton]
- Sintezo de nitramido:
Reakcio 11[redakti | redakti fonton]
- Preparado de nitrila kvarfluoroborato:[5]
Literaturo[redakti | redakti fonton]
- NCBI Resources
- InChem
- ResearchGate
- Advances in Inorganic Chemistry and Radiochemistry
- General Chemistry
- The Chemistry of the Non-Metals







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)