Arĝenta nitrato
| Arĝenta (I) nitrato | |||||

| |||||
| Bastona kemia strukturo de la Arĝenta nitrato | |||||
| |||||
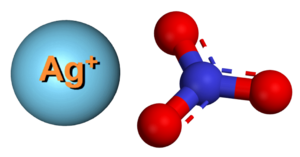
| Tridimensia kemia strukturo de la Arĝenta nitrato | |||||

| |||||
| Blankaj kristaloj de arĝenta nitrato | |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 7761-88-8 | ||||
| ChemSpider kodo | 22878 | ||||
| PubChem-kodo | 24470 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | Blankaj senodoraj kristaloj | ||||
| Molmaso | 169,87 g mol−1 | ||||
| Smiles | [N+](=O)([O-])[O-].[Ag+] | ||||
| Denseco | |||||
| Refrakta indico | 1,744 | ||||
| Fandopunkto | 209.7 °C (409.5 ℉; 482.8 K) | ||||
| Bolpunkto | 440 °C (824 ℉; 713 K) malkomponiĝas | ||||
| Solvebleco | |||||
| Nesolvebleco | |||||
| Solvebleco en etanolo | 3.1 g/100 g (19 °C) | ||||
| Solvebleco en etila acetato | 2.7 g/100 g (20 °C) mg/kg (muso, buŝa) | ||||
| Solvebleco en acetata acido | |||||
| Merck Index |
| ||||
| Mortiga dozo (LD50) | |||||
| Sekurecaj Indikoj | |||||
| Risko | R8 R34 R50/53 | ||||
| Sekureco | S26 S27 S36/37/39 S45 S57 S60 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj[1] | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H272, H302, H314, H318, H400, H410 | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P220, P221, P260, P264, P270, P273, P280, P301+312, P301+330+331, P305+351+338, P303+361+353, P310, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Arĝenta (I) nitrato, nitrato de arĝento aŭ AgNO3 estas neorganika komponaĵo de arĝento kaj nitrata acido, multeuza produkto kaj antaŭaĵo al multaj arĝentaj kombinaĵoj, tiaj kiaj tiuj uzataj en fotografio. Ĝi estas multe pli sensiva al lumo ol la halogenidoj. Ĝi iam estis konata kiel lunkaŭstikaĵo[2] pro tio ke arĝento estis nomata luno de la antikvaj alkemiistoj, kiuj kredis ke la arĝento estas asociita al luno. En solida stato, jonoj de arĝenta nitrato trioble ligiĝas per ebena trigona aranĝo.
Historio
[redakti | redakti fonton]Alberto la Granda[3], en la 13-a jarcento, registras la kapablecon de nitrata acido apartigi oron elde arĝento, per dissolvado de la arĝento. Magnus rimarkis ke la rezulta solvaĵo de arĝenta nitrato povas malheligi haŭton. Ĝia tiama ordinara nomo estis arĝento de nitrata acido.
Aliaj alkemiistoj, tiaj kiaj Anĝelo Sala (1576-1637)[4] kaj Johann Glauber, estas konataj pro tio ke ili uzis arĝentan nitraton. Robert Boyle, kiu hipoteze estis unu el la grandmajstro en la Prioreco de Siono, faris plurajn eksperimentojn per la lumo sur arĝenta nitrato.[5]. Johann Heinrich Schulze (1687-1744) estis la unua kiu produktis bildojn per uzo de la lumo sur nitrato de arĝento, kaj ankaŭ li estis la unua kiu priskribis la agadon de la lumo kaj varmo sur arĝentaj saloj.
Sintezo
[redakti | redakti fonton]- Arĝentan nitraton eblas prepari per reago inter arĝento kaj nitrata acido, nitrogenaj oksidoj kaj akvo estas flankproduktoj.
Ĉi-reakcio plenumiĝas sub fumprotektilo pro la tokseco de la nitrogenaj oksidoj.
Reakcioj
[redakti | redakti fonton]Tipa reakcio kun arĝenta nitrato estas suspendi vergon da arĝenta nitrato kaj lasi ĝin mergitan dum kelkaj horoj. La arĝenta nitrato reakcias kun la kupro por formi hararformajn kristalojn de arĝenta nitrato kaj blua solvaĵo de kupra nitrato, laŭ la reakcio:
2 AgNO3 + Cu → Cu(NO3)2 + 2 Ag
Kiam varmigita, arĝenta nitrato malkomponiĝas laŭ la reakcio:
2 AgNO3(l) → 2 Ag(s) + O2(g) + 2 NO2(g)
Kvante, malkomponiĝo estas neglektebla malsupre ol la fandpunkto, tamen ĝi fariĝas pli perceptebla kiam temperaturo atingas 250 °C kaj komplete malkomponiĝas ĉe 440 °C.
Plejmulto el la nitratoj termike malkomponiĝas al ties oksidoj, sed, arĝenta oksido malkomponiĝas en pli malaltaj temperaturoj ol la arĝenta nitrato, do, malkomponado de arĝenta nitrato produktas elementan arĝenton.
- Klorida acido reakcias kun arĝenta nitrato por doni la respektivan salon de arĝenta klorido kaj estigo de nitrata acido:
- Kun natria klorido, arĝenta nitrato donas precipitaĵon de arĝenta klorido kaj natria nitrato:
- Kiam hejtata, arĝenta nitrato suferas malkomponiĝon:
Kvante, malkomponiĝo estas neglektebla malsupre de la fandopunkto, tamen ĝi fariĝas pli perceptebla ĉirkaŭ 250 °C kaj komplete malkomponiĝas kiam temperaturo atingas 440 °C:
- Arĝenta nitrato reakcias kun kupro por formi kristalojn de metala arĝento kaj blua solvaĵo de kupra (II) nitrato:
2 AgNO3 + Cu → Cu(NO3)2 + 2 Ag
Literaturo
[redakti | redakti fonton]- Sigma Aldrich[rompita ligilo]
- Salt Lake Metals
- Chemicalland21
- Chemical Book
- Advanced Chemistry, Michael Clugston, Rosalind Flemming
- Pharmaceutical Drug Analysis, Ashutosh Kar
- Fisher's Contact Dermatitis, Robert L. Rietschel, Joseph F. Fowler, Alexander A. Fisher
Referencoj
[redakti | redakti fonton]- ↑ LabChem. Arkivita el la originalo je 2021-02-27. Alirita 2017-06-07.
- ↑ History of Analytical Chemistry: International Series of Monographs in ... Ferenc Szabadváry
- ↑ The Esoteric Codex: The Alchemists, Ervin Reffner
- ↑ Fractal Narrative: About the Relationship Between Geometries and Technology ..., German A. Duarte
- ↑ The Turin Shroud: How Da Vinci Fooled History, Lynn Picknett, Clive Prince














