Flavanono
| Flavanono | |||
 | |||
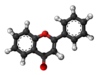
| Plata kemia strukturo de la Flavanono | |||
 | |||
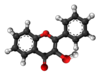
| Tridimensia kemia strukturo de la Flavanono | |||
 | |||
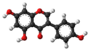
| Numerigo de la karbonaj strukturoj de la flavanonoj. | |||
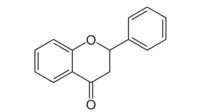
| Kemia formulo | |||
| CAS-numero-kodo | 487-26-3 | ||
| ChemSpider kodo | 9833 | ||
| PubChem-kodo | 10251 10251 | ||
| Fizikaj proprecoj | |||
| Aspekto | flava solidaĵo | ||
| Molmaso | 224,255 g·mol−1 | ||
| Denseco | 1,217g cm−3 | ||
| Fandpunkto | 76 °C-78 °C[1] | ||
| Bolpunkto | 386,2 °C | ||
| Refrakta indico | 1,603 | ||
| Ekflama temperaturo | 181,9 °C | ||
| Acideco (pKa) | 7,86 | ||
| Solvebleco | Akvo:0,48 g/L | ||
| Mortiga dozo (LD50) | 75 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R22 R36/37/38 | ||
| Sekureco | S26 S36/37/39 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H302 | ||
| GHS Deklaroj pri antaŭgardoj | P264, P270, P301+312, P330, P501[2] | ||
(25 °C kaj 100 kPa) | |||
Flavanono aŭ C15H12O2 estas natura fitokemiaĵo kies strukturo estas karakterizita per benzopiranona nukleo substituita en la pozicio 2 per arila karbonkateno. Multaj flavonoidoj enhavantaj fenolan aŭ prenolan[3] substituadon estis izolitaj kaj posedas farmakologiajn bioaktivecojn. Sciencaj eksperimentoj raportas ke ekzistas pli ol tri mil membrojn de la flavanoida familio, nur kun flavanonaj rondoj.
La unua flavanono, la naringino, kiu estas glukozido de la naringenino, estis malkovrita en 1857 de DeVry, ekstraktita el la floroj de vinberujoj en Javo.[4] Ĝenerale, la flavanonoj estas flavaj solidaĵoj, amargustaj, nesolveblaj en akvo sed solveblaj en nepolaraj organikaj solvantoj tiaj kiaj metanolo, etanolo, acetono, kloroformo, duetila etero, acetata acido kaj benzeno. Flavanonoj, samkiel la flavonoidoj, posedas antioksidigajn, antitumorajn, antiinflamajn kaj antikancerajn proprecojn.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado ekde la apigenino per reduktado en la 2-a pozicio de la kromenonila grupo, forigo de du hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj forigo de hidroksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 2
[redakti | redakti fonton]- Preparado ekde la flavono per reduktado en la 2-a pozicio de la kromenonila grupo:
Sintezo 3
[redakti | redakti fonton]- Preparado ekde la flavonolo per reduktado en la 2-a pozicio de la kromenonila grupo kaj aldono de hidroksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 4
[redakti | redakti fonton]- Preparado ekde la genisteino per reduktado en la 2-a pozicio de la kromenonila grupo, forigo de du hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj forigo de hidroksila grupo en la 4-a pozicio de la fenila grupo:
Sintezo 5
[redakti | redakti fonton]- Preparado ekde la kverketino per reduktado en la 2-a pozicio de la kromenonila grupo, forigo de tri hidroksilaj grupoj en la 3-a, 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj forigo de du hidroksilaj grupoj en la 4-a kaj 5-a pozicioj de la fenila grupo:
Sintezo 6
[redakti | redakti fonton]- Preparado ekde la luteolino per reduktado en la 2-a pozicio de la kromenonila grupo, forigo de du hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj forigo de du hidroksilaj grupoj en la 4-a kaj 5-a pozicioj de la fenila grupo:
Sintezo 7
[redakti | redakti fonton]- Preparado ekde la naringenino per forigo de du hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj forigo de hidroksila grupo en la 4-a pozicio de la fenila grupo:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Konvertado al apigenino per oksidado en la 2-a pozicio de la kromenonila grupo, aldono de du hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj aldono de hidroksila grupo en la 4-a pozicio de la fenila grupo:
Reakcio 2
[redakti | redakti fonton]- Konvertado al flavono per oksidado en la 2-a pozicio de la kromenonila grupo:
Reakcio 3
[redakti | redakti fonton]- Konvertado al flavonolo per oksidado en la 2-a pozicio de la kromenonila grupo kaj forigo de hidroksila grupo en la 4-a pozicio de la fenila grupo:
Reakcio 4
[redakti | redakti fonton]- Konvertado al genisteino per oksidado en la 2-a pozicio de la kromenonila grupo, aldono de du hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj aldono de hidroksila grupo en la 4-a pozicio de la fenila grupo:
Reakcio 5
[redakti | redakti fonton]- Konvertado al kverketino per oksidado en la 2-a pozicio de la kromenonila grupo, aldono de tri hidroksilaj grupoj en la 3-a, 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj aldono de du hidroksilaj grupoj en la 4-a kaj 5-a pozicioj de la fenila grupo:
Reakcio 6
[redakti | redakti fonton]- Konvertado al luteolino per oksidado en la 2-a pozicio de la kromenonila grupo, aldono de du hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj aldono de du hidroksilaj grupoj en la 4-a kaj 5-a pozicioj de la fenila grupo:
Reakcio 7
[redakti | redakti fonton]- Konvertado al naringenino per aldono de du hidroksilaj grupoj en la 5-a kaj 7-a pozicioj de la kromenonila grupo, kaj aldono de hidroksila grupo en la 4-a pozicio de la fenila grupo:
Literaturo
[redakti | redakti fonton]- Chemicalbook
- Science Direct
- Natural Production Communications
- The Science of Flavonoids
- Flavonoids of the Sunflower Family
- Polyphenols in Human Health and Disease
- Fruit Phenolics
- Flavonoid Metabolism





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)