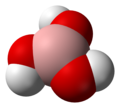
Borata acido
| Borata acido | ||

| ||

| ||

| ||
| Sasolito:Mineralo enhavanta Boratan acidon | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | H3BO3 | |
| PubChem-kodo | 7628 | |
| ChemSpider kodo | 7346 | |
| CAS-numero-kodo | 10043-35-3 | |
| Fizikaj proprecoj | ||
| Aspekto | blanka kristaleca solido | |
| Molmaso | 61.832 g mol−1 | |
| Smiles | OB(O)O | |
| Denseco | 1.435 g/cm3 (likva) | |
| Fandopunkto | 170.9 °C (339.6 ℉; 444.0 K) | |
| Bolpunkto | 300 °C (572 ℉; 573 K) | |
| Solvebleco | ||
| Mortiga dozo (LD50) | 2660 mg | |
| Ekflama temperaturo | nebrulema | |
| Sekurecaj Indikoj | ||
| Risko | ||
| Sekureco | ||
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj[1] | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Damaĝa substanco | |
| GHS Deklaroj pri damaĝoj | H360FD | |
| GHS Deklaroj pri antaŭgardoj | P201, P202, P280, P308+313, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Borata acido aŭ ortoborata acido estas malforta unubaza acido de Lewis ofte uzatas kiel antisepsaĵo, insekticido, flaminhibanto, neŭtrona absorbanto, kaj antaŭulo de aliaj kemiaj kombinaĵoj. Ĝia kemia formulo estas H3B3 -- aŭ B(OH)3) -- kaj trovata laŭ la formo de senkoloraj kristaloj aŭ blanka pulvoro kiu dissolviĝas en akvo. Kiam okazante kiel mineralo, ĝi nomatas sasolito[2].
Boraj kombinaĵoj uzatas kiel malforta insekticido kontraŭ formikoj, blatologaĵoj kaj puloj de katoj kaj hundoj, hejma purigado, agento por bufrokontrolo[3], okullavaĵoj, kaj kontraŭaglomera agento[4]. Dum ingestadoj estas ordinaraj, serioza tokseco estas malofta pro la granda kvanto de la produkto bezonata por esti ingestida. Tamen, ingestoj klinike signifoplenaj karakteriziĝas per vomado, diareo, anoreksio, letargio kaj (tre rare) renruinigo[5].
Historio
[redakti | redakti fonton]En 1702, borata acido estis unue preparita de Wilhelm Homberg (1652-1715) ekde miksaĵo de Natria kvarborato, pere de la ago de mineralacidoj, tre eble la jam konata verda vitriolo, kaj tiam ĝi ricevis la nomon sedativa salo de Hombergo. Malgraŭ tio, ĝi eble jam estis konata de la alkemiisto Johann Joachim Becher (1635-1682) ĉirkaŭ 1675. Nur en 1747, oni sukcesis pruvi ke borakso estas kombinaĵo de sodo kaj ĉi-tiu sedativa salo.
Tamen, boratoj, inklude de la borata acido, daŭre estas uzataj ekde la tempo de la antikvaj grekoj por diversaj taskoj samkiel purigado, manĝokonservado kaj aliaj hejmuzoj. Nuntempe borata acido uzatas en diversaj aplikaĵoj en komerco, agrikulturo kaj nukleaj kampoj. En 1774, iu florenca apotekisto, Uberto Francesko Höfer[6], trovis la "sal sedativum" en la akvoj de certa toskana termolageto, tamen nur en 1810 oni industrie provis starigi fabrikon de borata acido el la akvoj de tiuj lagoj larĝaskale. Nuntempe, la plejmulto el la borata acido en la Eŭropa merkat derivas el ĉi tiuj etaj lagoj en la vulkanaj distriktoj de Toskanio.
Kvankam pli efikaj kiel polvoj, borata acido kaj borakso antaŭlonge rekomendatas kiel logaĵoj solidaj aŭ likvaj. Borata acido estas pli aktiva kontraŭ la Blatella germanica ol la borakso. Arnold Mallis[7] (1969) rimarkis ke la uzo de borata acido kaj borakso pliiĝis kiam natria fluorido kaj piretro estis mankantaj dum la dua mondmilito.
En 1808, Gay-Lussac (1778-1850) kaj Louis-Jacques Thénard (1777-1857) sukcesis izoli tion, kion ili nomis radikalo de la borata acido, tute nesciante ke ili estis malkovrinta la elementon. Ili faris la eksperimenton varmigante boratan acidon kun la kalia metalo, kie la nesolvebla porcio de la reakciantoj estis la radikalo. Ili daŭrigis ilian esploron dumsomere, forpurigante la elementon per varmigado de ties oksido (B2O3) kun kalio. Ili anoncis la malkovron de la nova elemento nur en novembro, unu monato antaŭ ol Humphry Davy (1778-1829) same asertis ke li izolis ĝin[8].
Okazejo
[redakti | redakti fonton]Krom la vulkanaj regionoj de Toskanio, la borata acido trovatas kiel liberstata mineralo, konata kiel sasolito, en la usona ŝtato Nevado. Aliaj mineraloj enhavantaj boratan acidon troviĝas ankaŭ en la naturo tiel kiel borakso, boracito[9], boronatrokaicito[10], kernito[11] kaj kolemanito[12]. Sammaniere, borata acidoj kaj ties saloj troviĝas en la maraj salakvoj. Ĝi same trovatas en plantoj inklude de preskaŭ ĉiuj fruktoj tiel kiel pomo, banano, migdalo kaj arakido.
Literaturo
[redakti | redakti fonton]- 1911 Encyclopædia Britannica
- Creation Wiki
- Cheshire Medical Center Arkivigite je 2015-06-18 per la retarkivo Wayback Machine
- Science jrank
- A Dictionary of Science, Elizabeth A. Martin
- Drugs.com
- Boric acid ophthalmic Side Effects Arkivigite je 2015-06-18 per la retarkivo Wayback Machine
- eHow
- Medicine Health Arkivigite je 2015-06-18 per la retarkivo Wayback Machine
- Side Effects of Boric Acid Use
- TheFreeDictionary
- Boric acid poisoning, University of Maryland Medical Center
- MedlinePlus
- New World Encyclopedia
- Fruit Flies: Biology and Management, Martin Aluja, Pablo Liedo
- Encyclopedia of Water Science (Print), Bobby A. Stewart,Terry Howell
Belaj prezentaĵoj de Youtube
[redakti | redakti fonton]- How To Make Boric Acid
- how to make boric acid from Borax
- How to KILL Mosquitoes with fruit juice and boric acid. Cheap and easy & lasts a month!
- Boric Acid for effective, cheap pantry moth and sugar ant control
- Get rid of Cockroaches from your homes forever
- Top Ten Secrets - #3 Ant Control
Preparado
[redakti | redakti fonton]Borato de hidrogeno estas preparebla reakciante borakso (natria kvarborato dekohidratohava) kun mineralaj acidoj, tiel kiel klorida acido:
Na2B4O7·10H2O + 2 HCl → 4 B(OH)3 [aŭ H3BO3] + 2 NaCl + 5 H2O
Ĝi ankaŭ estiĝas kiel flankprodukto el la hidrolizo de boraj trihalogenidoj kaj duborano (B2H6):[13]
B2H6 + 6 H2O → 2 B(OH)3 + 6 H2[14]
H2B4O7 → 2 B2O3 + H2O
Proprecoj
[redakti | redakti fonton]Borata acido estas solvebla en bolanta akvo. Kiam varmigita pli ol 170 °C, ĝi senhidratiĝas, estigante metaboratan acidon aŭ HBO2.
H3BO3 → HBO2 + H2O
Metaborata acido estas blanka, kuba kristaleca solido kaj tre malmulte solvebla en akvo. Metaborata acido fandiĝas ĉirkaŭ 236 °C, kaj kiam varmigita pli ol 300 °C, ĝi plu senhidratiĝas, estigante kvarboraran acidon aŭ piroboratan acidon (H2B4O7):
4 HBO2 → H2B4O7 + H2O
La vorto borata acido kelkfoje povas referenci al ajna el ĉi tiuj kombinaĵoj. Plua varmigo produktas la bora trioksido.
BX3 + 3 H2O → B(OH)3 + 3 Hx (X = Cl, Br, I)
H2B4O7 → 2 B2O3 + H2O
Ekzistas konfliktaj interpretadoj pri la origino je la acideco de akvaj solvaĵoj kun borata acido. La spektroskopio de Raman rilate al forte alkalaj solvaĵoj montras la ĉeeston de la jono B(OH)−4, devigante kelkajn konkludi ke la acideco estas ekskluzive pro la abstrakteco de la grupo OH− el la akvo:[15][16]
B(OH)3 + H2O ![]() B(OH)−4 + H+ (K = 7.3x10−10; pK = 9.14)
B(OH)−4 + H+ (K = 7.3x10−10; pK = 9.14)
aŭ pli adekvate esprimata en akva solvaĵo:
B(OH)3 + 2 H2O ![]() B(OH)−4 + H3O+
B(OH)−4 + H3O+
Ĉi-tio povas karakteriziĝi kiel acido de Lewis de la boro rilate al la grupo OH−, anstataŭ kiel acido de Brønsted.
Tamen, aliaj fontoj[17] asertas ke borata acido same estas tribaza acido de Brønsted, kun sinsekvaj jonigaj etapoj:
- B(OH)3
 BO(OH)−2 + H+ (Ka1 = 5.8x10−10; pKa1 = 9.24)
BO(OH)−2 + H+ (Ka1 = 5.8x10−10; pKa1 = 9.24)
- BO(OH)−2
 BO2(OH)2− + H+ (Ka2 = 4x10−13; pKa2 = 12.4)
BO2(OH)2− + H+ (Ka2 = 4x10−13; pKa2 = 12.4)
- BO2(OH)2−
 BO−3 + H+ (Ka3 = 4x10−14; pKa3 = 13.3)
BO−3 + H+ (Ka3 = 4x10−14; pKa3 = 13.3)
- Pro tio ke la valoro de Ka1 estas komparebla al tiu de la reakcio kun OH−, la koncentriĝoj de B(OH)−2 kaj B(OH)−4 estas similaj.
Poliborataj anjonoj formiĝas je pH 7–10 kiam la koncentriĝo de boro estas pli alta ol proksimume 0.025 mol/L. La plej konata el ĉi tiuj estas la 'tetraborata' jono, trovata en la mineralo borakso:
4[B(OH)4]− + 2H+ ![]() [B4O5(OH)4]2− + 7H2O
[B4O5(OH)4]2− + 7H2O
Borata acido igas gravan kontribuaĵon por la absorbiĝo de la basfrekvenca sono en la marakvo.[18]
Kristaleca strukturo
[redakti | redakti fonton]La kristaleca borata acido konsistas pri tavoloj de molekuloj da B(OH)3 kunkonservitaj per hidrogenaj ligoj. La ligolongo inter la atomoj B-O estas je 136 pm kaj de la atomoj O-H 97 pm kune kun hidrogena ligo je 272 pm. La distanco inter du apudaj tavoloj estas je 318 pm.
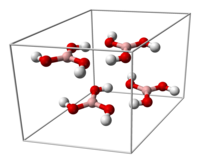 |
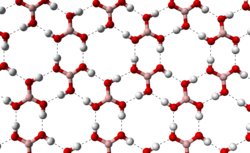 |
permesas ke molekuloj de borata acido estigu paralelajn tavolojn en la solida stato |
Toksologio
[redakti | redakti fonton]Borata acido povas esti toksa laŭ pluraj vojoj[19]:
- buŝa: al homoj kaj bestoj depende de la koncentriĝo ingestita
- haŭta: kvantoj pli altaj ol 200 mg/kg povas esti danĝeraj
- inhalado: ĝi povas esti irita aŭ koroda kiam inhalita dum longaj periodoj
- Okuloj:Ĝi povas esti koroda aŭ irita kiam en kontakto kun la okuloj
- Surbaze de mortiga dozo por mamuloj (LD50) kiu rangas po 2,660 mg/kg korpa maso, borata acido estas venena se interne ingestita aŭ grandkvante inhalita. La 13-a eldono de la referenca libro por kemiaĵoj, Merck Index[20], indikas ke la (MD50) por la borata acido estas 5.14 g/kg al buŝaj dozoj faritaj kun ratoj, kaj inter 5 ĝis 20 g/kg por mortokaŭzo en adoltaj homoj. Por kompara efekto, la (MD50) de la salo raportiĝas esti 3,75 g/kg en ratoj laŭ la Merck Index. Tamen, ĉi valoroj estas alte eraraj, pro tio ke homoj estas konataj kiuj mortas per eta kvanto de la (MD50). La minimuma mortiga dozo de ingestita boro (en la formo de borata acido) raportiĝis esti inter 2-3 g por beboj, 5-6 por infanoj, kaj 15-20 por adoltoj, laŭ la Agentejo por Registroj pri Toksaj Substancoj kaj Malsanoj[21]
Longotempa ekspozicio al la borata acido povas kaŭzi maltrankvilon, provoki rendamaĝoj kaj eventuale renruinigo. Kvankam la borato de hidrogeno ŝajne ne estas kancerogenera, studoj en hundoj raportas iom da testiklo-atrofio post ekspozicio supera al 32 mg/kg korpopezo/tago dum 90 tagoj. Ĉi-nivelo estas multe pli malalta ol la (MD50).
Vidu ankaŭ
[redakti | redakti fonton]-
Borano -
B2O3 -
Duborano -
Etila borato -
Piretro -
H2B4O7
Referencoj
[redakti | redakti fonton]- ↑ LabChem. Arkivita el la originalo je 2016-12-13. Alirita 2017-06-06.
- ↑ Health & Drugs: Disease, Prescription & Medication, Nicolae Sfetcu
- ↑ Bufro: en kemio, bufro estas substanco kiu stabligas la valoron de pH ene de iu miksaĵo.
- ↑ Kontraŭaglomeraj agentoj estas nutrosubstancoj tre uzata en polvaj manĝaĵoj por eviti ke ili aglomeriĝu.
- ↑ Clinical Veterinary Advisor: Dogs and Cats, Etienne Cote
- ↑ Enciclopedia Italiana
- ↑ Handbook of Pest Control. Arkivita el la originalo je 2015-02-22. Alirita 2015-06-18.
- ↑ New World Encyclopedia
- ↑ Mindat.org
- ↑ Encyclopedia of the Alkaline Earth Compounds, Richard C. Ropp]
- ↑ The Pearson Guide to Objective Chemistry for the AIEEE, Singhal Atul
- ↑ Encyclopædia Britannica
- ↑ Chemistry and Chemical Reactivity, John Kotz, Paul Treichel, John Townsend
- ↑ Concise Encyclopedia Chemistry, Mary Eagleson
- ↑ Comprehensive Chemistry for JEE Advanced 2014, p15.5
- ↑ Competition Science Vision
- ↑ Link Springer
- ↑ National Physical Laboratory
- ↑ National Pesticide Information Center
- ↑ [https://web.archive.org/web/20150714190623/http://www.agri.huji.ac.il/library/WebUserHelpGuide.pdf Arkivigite je 2015-07-14 per la retarkivo Wayback Machine The Merck Index 14th Edition Web
- ↑ Agency for Toxic Substances and Disease Registry
|
Sekureco | |
|---|---|
| Ingestado | Toksa. Kaŭzas vomojn kaj diareojn kiam ingestia en malgrandaj dozoj, pli altaj dozoj povas esti fatalaj. |
| Inhalado | Povas kaŭzi iriton. |
| Haŭto | Povas kaŭzi iriton. |
| Okuloj | Povas kaŭzi iriton. |
| Pli da informoj | Hazardous Chemical Database Arkivigite je 2004-06-17 per la retarkivo Wayback Machine |
|
Unuoj de la ISU estis uzataj ĉiam kiam eblis. Escepte de la normoj. | |