Fisetino
Aspekto
| Fisetino | ||
 | ||
| Plata kemia strukturo de la Fisetino | ||
 | ||
| Tridimensia kemia strukturo de la Fisetino | ||
 | ||
| Fisetino estas flava antioksidigaĵo trovata en plantoj tia kia la Cotinus coggygria[1] | ||
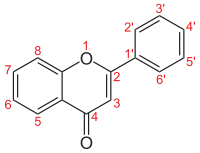 | ||
| Numerigo de la karbonaj strukturoj de la flavonoj. | ||
| Kemia formulo | ||
| CAS-numero-kodo | 528048-3 | |
| ChemSpider kodo | 4444933 | |
| PubChem-kodo | 5281614 | |
| Merck Index | 15,4119 | |
| Fizikaj proprecoj | ||
| Aspekto | flava solidaĵo | |
| Molmaso | 286,2363 g·mol−1 | |
| Denseco | 1,688g cm−3 | |
| Fandpunkto | 330 °C (malkomponiĝas) | |
| Bolpunkto | 559,4 °C[2] | |
| Refrakta indico | 1,784 | |
| Ekflama temperaturo | 233 °C | |
| Solvebleco | Akvo:0,151 g/L [3] | |
| Mortiga dozo (LD50) | 180 mg/kg (buŝe)[4] | |
| Sekurecaj Indikoj | ||
| Riskoj | R36/37/38 [5] | |
| Sekureco | S22 S24/25 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P321, P332+313, P337+313, P362, P403+233, P405, P501[6] | |
(25 °C kaj 100 kPa) | ||
Fisetino, (3',4',3,7-kvarhidrokso-flavono) aŭ C15H10O6 estas organika kunmetaĵo apartenanta al la familio de la flavonoidoj kaj trovata en multaj plantoj tiaj kiaj fragoj, pomoj, persimonoj, cepoj kaj kukumoj. Fisetino, kiu estas uzata kiel kolorigagento, estis esplorata, kune kun aliaj flavonoloj de la franca kemiisto Michel Eugène Chevreul (1786-1889). Inter 1814 kaj 1815 el la Cotinus coggygria li ekstraktis la fisetinon, luteolinon el la Reseda luteola kaj la morino el la Maclura tinctoria.[7] Fisetino estas flava solidaĵo, nesolvebla en akvo, duetila etero, benzeno, kloroformo, sed solvebla en etanolo, acetono, acetata acido kaj alkalaj solvaĵoj.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado ekde la apigenino per aldono de du hidroksilaj grupoj, unu en la 3-a pozicio de la kromenonila grupo kaj alia en la kvina pozicio de la fenila grupo:
Sintezo 2
[redakti | redakti fonton]- Preparado ekde la kempferolo per aldono de hidroksila grupo en la kvina pozicio de la fenila grupo kaj forigo de hidroksila grupo en la 5-a pozicio de la kromenonila grupo:
Sintezo 3
[redakti | redakti fonton]- Preparado ekde la krizino per aldono de tri hidroksilaj grupoj, du en la la pozicioj 4-a kaj 5-a de la fenila grupo, kaj tria en la 3-a pozicio de kromenonila grupo, kaj forigo de hidroksila grupo en la 5-a pozicio de kromenonila grupo:
Sintezo 4
[redakti | redakti fonton]- Preparado ekde la kverketino per forigo de hidroksila grupo en la 5-a pozicio de kromenonila grupo:
Sintezo 5
[redakti | redakti fonton]- Preparado ekde la luteolino per forigo de hidroksila grupo en la 5-a pozicio de la kromenonila grupo kaj aldono de hidroksila grupo en la 3-a pozicio de kromenonila grupo:
Sintezo 6
[redakti | redakti fonton]- Preparado ekde la miriketino per forigo de hidroksila grupo en la 5-a pozicio de kromenonila grupo kaj forigo de hidroksila grupo en la 3-a pozicio de fenila grupo:
Sintezo 7
[redakti | redakti fonton]- Preparado ekde la naringenino per forigo de hidroksila grupo en la 5-a pozicio de kromenonila grupo kaj aldono de hidroksila grupo en la 5-a pozicio de fenila grupo:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Konvertado al apigenino per forigo de du hidroksilaj grupoj, unu en la 3-a pozicio de la kromenonila grupo kaj alia en la kvina pozicio de la fenila grupo:
Reakcio 2
[redakti | redakti fonton]- Konvertado al kempferolo per forigo de hidroksila grupo en la kvina pozicio de la fenila grupo kaj aldono de hidroksila grupo en la 5-a pozicio de la kromenonila grupo:
Reakcio 3
[redakti | redakti fonton]- Konvertado al krizino per forigo de tri hidroksilaj grupoj, du en la la pozicioj 4-a kaj 5-a de la fenila grupo, kaj tria en la 3-a pozicio de kromenonila grupo, kaj aldono de hidroksila grupo en la 5-a pozicio de kromenonila grupo:
Reakcio 4
[redakti | redakti fonton]- Konvertado al kverketino per aldono de hidroksila grupo en la 5-a pozicio de kromenonila grupo:
Reakcio 5
[redakti | redakti fonton]- Konvertado al luteolino per aldono de hidroksila grupo en la 5-a pozicio de la kromenonila grupo kaj forigo de hidroksila grupo en la 3-a pozicio de kromenonila grupo:
Reakcio 6
[redakti | redakti fonton]- Konvertado al miriketino per aldono de hidroksila grupo en la 5-a pozicio de kromenonila grupo kaj aldono de hidroksila grupo en la 3-a pozicio de fenila grupo:
Reakcio 7
[redakti | redakti fonton]- Konvertado al naringenino per aldono de hidroksila grupo en la 5-a pozicio de kromenonila grupo kaj forigo de hidroksila grupo en la 5-a pozicio de fenila grupo:
Literaturo
[redakti | redakti fonton]- Science Direct
- NCBI Resources
- Role of Nutraceuticals in Cancer Chemosensitization
- Anti-inflammatory Nutraceuticals and Chronic Diseases
- Translational Stroke Research: From Target Selection to Clinical Trials
- Lewis Lung Cancer: New Insights for the Healthcare Professional
- Cysteine Endopeptidases: Advances in Research and Application
- Issues in Cancer Epidemiology and Research





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)