Klorosulfata acido
| Klorosulfata acido | |||

| |||
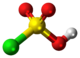
| Kemia strukturo de la Klorosulfata acido | |||
| |||
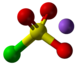
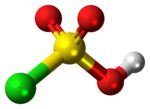
| 3D Kemia strukturo de la Klorosulfata acido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 7790-94-5 | ||
| ChemSpider kodo | 23040 | ||
| PubChem-kodo | 24638 | ||
| Fizikaj proprecoj | |||
| Aspekto | Senkolora likvaĵo fumiganta en la aero | ||
| Molmaso | 116.52 g mol−1 | ||
| Smiles | O=S(O)(Cl)=O | ||
| Denseco | 1753 g/cm3 | ||
| Refrakta indico | 1 433 | ||
| Fandopunkto | −80 °C (−112 ℉; 193 K) | ||
| Bolpunkto | inter 151 kaj 152 °C (304 kaj 306 ℉; 424 kaj 425 K) (755 mmHg aŭ 100.7 kPa) | ||
| Ekflama temperaturo | 158 °C | ||
| Merck Index |
| ||
| Sekurecaj Indikoj | |||
| Risko | R14 R35 | ||
| Sekureco | S2 S26 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H314, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P261, P280, P305+351+338, P310 | ||
(25 °C kaj 100 kPa) | |||
Klorosulfata acido, klorosulfonata acido aŭ ClSO2OH estas neorganika kombinaĵo, klora salo de sulfonata acido, senkolora distilebla likvaĵo, tre higroskopa kaj potenca larmigagento. Ĝi forte reakcias kun akvo por estigi kloridan acidon kaj sulfatan acidon.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per traktado de klorida acido kaj sulfata acido:
Sintezo 2[redakti | redakti fonton]
- Preparado per traktado de fosfora pentaklorido kaj sulfata acido:
Sintezo 3[redakti | redakti fonton]
- Preparado per traktado de sulfurila klorido kaj zinka hidroksido:
Sintezo 4[redakti | redakti fonton]
- Preparado per reduktado de sulfurila klorido kun natria sulfito en akva medio:
Sintezo 5[redakti | redakti fonton]
- Preparado per traktado de natria klorosulfonato kaj klorida acido:
Sintezo 6[redakti | redakti fonton]
- Preparado per traktado de kloro kaj sulfita acido:
Sintezo 7[redakti | redakti fonton]
- Preparado per interagado de sulfurila klorido kun natria klorido:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Sapigo de la klorosulfonata acido
Reakcio 2[redakti | redakti fonton]
- Esterigo de la klorosulfonata acido:
Reakcio 3[redakti | redakti fonton]
- Preparado de klorosulfonilamido per amonolizo de la klorosulfonata acido:
Reakcio 4[redakti | redakti fonton]
- Preparado de sulfurila klorido per traktado de klorosulfonata acido kun kloro:
Reakcio 5[redakti | redakti fonton]
- Reakcio kun kloramino:
Reakcio 6[redakti | redakti fonton]
- Reakcio kun sodamido en acida medio:
Reakcio 7[redakti | redakti fonton]
- Reakcio kun nitrozila klorido:
Reakcio 8[redakti | redakti fonton]
- Preparado de saĥarino per interagado de klorosulfonata acido, p-klorotolueno kaj dukloramino:
Proprecoj[redakti | redakti fonton]
Klorosulfata acido estas kvaredra molekulo, peraĵo, kemie kaj koncepte, inter sulfurila klorido (SO2Cl2) kaj sulfata acido. La komponaĵo rare preparatas pura, kaj kiam ekspoziciita al troo da sulfura trioksido, ĝi malkomponiĝas al pirosulfurila klorido aŭ klorosulfonata anhidrido.
Industrie ĝi produktatas pere de reakcio inter klorida acido kaj sulfura trioksido.
Literaturo[redakti | redakti fonton]
- Sigma Aldrich
- Chemicalize
- Chemical Book
- Cameo Chemicals
- Reag.paperplane.io[rompita ligilo]
- Centroj por Kontrolo kaj Preventado de Malsanoj
- Chlorosulfonic Acid, Richard James William Cremlyn
- Introduction to Organic Laboratory Techniques: A Small Scale Approach, Donald L. Pavia
- Anionic Surfactants: Organic Chemistry, Helmut W. Stache
| ||||||





![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)