p-Tolueno-sulfonata acido
| p-Tolueno sulfonata acido | ||

| ||
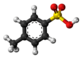
| Kemia strukturo de la p-Tolueno sulfonata acido | ||

| ||
| 3D Kemia strukturo de la p-Tolueno sulfonata acido | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | ||
| CAS-numero-kodo | 104-15-4 | |
| ChemSpider kodo | 5876 | |
| PubChem-kodo | 6101 | |
| Fizikaj proprecoj | ||
| Aspekto | Senkoloraj aŭ blankaj kristaloj | |
| Molmaso |
| |
| Denseco |
| |
| Fandopunkto | 38 °C (100 ℉; 311 K) (anhidra) inter 103 kaj 106 °C (inter 217 kaj 223 ℉; inter 376 kaj 379 K) (unuhidrata)" | |
| Bolpunkto | 140 °C (284 ℉; 413 K) sub 20 mmHg | |
| Solvebleco | Akvo:67 g/100 mL | |
| Acideco (pKa) |
| |
| Mortiga dozo (LD50) | 2570 mg/kg (muso, buŝa) | |
| Sekurecaj Indikoj | ||
| Risko | R36 R37 R38 | |
| Sekureco | S26 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P302+352, P304+340, P305+351+338 | |
(25 °C kaj 100 kPa) | ||
p-Tolueno sulfonata acido, PTSA, hidrogena p-tolueno-sulfonato aŭ CH3C6H4SO2OH estas organika aromata kombinaĵo, blanka solido solvebla en akvo, etanolo kaj aliaj polaraj organikaj solvantoj. La substanco estas konata kiel tozila grupo, mallongigita kiel Tz aŭ Toz. Plej ofte, TzOH rilatas al la unuhidrata produkto.
Tiel kiel la sulfonata acido, TzOH estas forta organika acido. Ĝi estas unu milionfoje pli forta ol benzoata acido. Ĝi estas unu el la malmultaj fortaj acidoj kiuj estas solido, kaj do, konvene pesita. Same, kontraŭe al kelkaj mineralaj acidoj (specife nitrata acido, sulfata acido kaj perklorata acido, TzOH estas neoksidiga.
Sintezo[redakti | redakti fonton]
TzOH preparata industriskale per sulfonigo de tolueno. Tiu produkto facile hidratiĝas. La ordinaraj malpuraĵoj inkludas benzeno-sulfonatan acidon kaj sulfatan acidon. Malpuraĵoj povas removiĝi per kristaliĝo de koncentritaj akvo-solvaĵoj sekvata de azeotropa sekigado per tolueno.
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Kiam hejtata kun akvo kaj acido, hidroliza reakcio okazas kaj tolueno estiĝas:
Reakcio 2[redakti | redakti fonton]
- Sintezo de p-tolueno-sulfonata anhidrido ekde p-tolueno-sulfonata acido kaj dufosfora kvinoksido:
Proprecoj[redakti | redakti fonton]
TzOH trovas aplikojn en organikaj sintezoj kiel "organika-solvebla" acida katalizilo. Kelkaj uzoj estas:
- Acetiligo (H3C-COO-) de aldehidoj.
- Esterigo[2] de karboksilataj acidoj
- Transesterigo de estero.[3]
Tozilataj esteroj[redakti | redakti fonton]
La esteroj de tozilata acido estas alkiligagentoj pro la elektronaltira efekto de tiu kemia grupo, igante la anjonan grupon bonan apartivan grupon. La tozila grupo same estas protekta grupo por alkoholoj kaj aminoj, preparitaj per kombinado de alkoholo kun p-toluenosulfonila klorido, kiu ĝenerale estas senprotona solvanto, ofte iu piridino, kies baza naturo aktivas la reakcion. Reduktiĝo de tozilataj esteroj estigas la respektivajn hidrokarbonidojn. Tiamaniere ke, toziligo sekvata per reduktiĝo rezultas en la senoksigenigo de alkoholoj.
YouTube[redakti | redakti fonton]
- P-Toluenesulfonic acid
- Synthesis of p-Toluenesulfonic Acid Monohydrate
- P-Toluenesulfonic Acid Synthesis
- acid calcium phosphate - para toluene sulfonic acid - sodium para toluene sulfonate
Literaturo[redakti | redakti fonton]
- UCLA
- ACS Publications
- Strong Acids - Boundless[rompita ligilo]
- Chemicalland21
- Guidechem
- Sigma Aldrich
- Chemical Book
| ||||||
Vidu ankaŭ[redakti | redakti fonton]
Referencoj[redakti | redakti fonton]
- ↑ Guidechem
- ↑ Esterigo ĝenerale estas reakcio inter karboksilata acido kaj alkoholo.
- ↑ Organic Chemistry, Enhanced Edition, William Brown, Christopher Foote, Brent Iverson, Eric Anslyn




![{\displaystyle {\mathsf {{\xrightarrow[{}]{H_{2}SO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a91dd08456a5acd28298697e8e92c1123b59ed37)