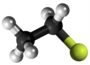Kloroetano
Etoso
| Kloroetano | |||||
 | |||||
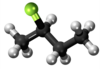
| Plata kemia strukturo de la Kloroetano | |||||
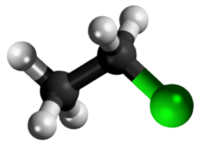 | |||||
| Tridimensia kemia strukturo de la Kloroetano | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 75-00-3 | ||||
| ChemSpider kodo | 6097 | ||||
| PubChem-kodo | 6337 | ||||
| Merck Index | 15,3837 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora, potence toksa, brulema gaso kun karakteriza tranĉe etera odoro | ||||
| Molmaso | 64,512 g·mol−1 | ||||
| Denseco | 0,921g cm−3 | ||||
| Fandpunkto | −138 °C | ||||
| Bolpunkto | 12,3 °C | ||||
| Refrakta indico | 1,3676[1] | ||||
| Ekflama temperaturo | −43 °C[2] | ||||
| Memsparka temperaturo | 510 °C | ||||
| Solvebleco | Akvo:5,7 g/L | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R12 R40 R52/53 | ||||
| Sekureco | S9 S16 S33 S36 S37 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H220, H280, H315, H319, H336, H351, H370, H371, H372, H402, H412 | ||||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P260, P261, P264, P270, P271, P273, P280, P281, P302+352, P304+340, P305+351+338, P314, P321, P332+313, P337+313, P362, P377, P381, P403, P403+233, P405, P410+403, P501[3] | ||||
(25 °C kaj 100 kPa) | |||||
Kloroetano aŭ C2H5Cl estas organika komponaĵo, rezultanta el kompleta interagado de etanolo kaj klorida acido, senkolora, potence toksa, alte brulema gaso kun karakteriza tranĉe etera aŭ dolĉeca odoro, uzata en kemiaj sintezoj kaj kiel reakciaĵo en laboratorioj. Ĝi uzatas en la produktado de plumba kvaretilo (iu benzina aldonaĵo), anesteziloj, insekticidoj, fridigado, kaj kiel solvanto por grasaĵoj, oleoj kaj ciroj.
Malgraŭ ke ĝi estas la malpli toksa el la klorhavaj hidrokarbonidoj, ĝi povas kaŭzi nelongedaŭran narkozon. Ĝi povas absorbiĝi per haŭto, okuloj kaj mukoza membrano. Ĝi estas milde toksa per ingestado. Akuta venenigo povas afekti hepaton, renojn, spirsistemon kaj koron.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]Sintezo 2
[redakti | redakti fonton]- Preparado per interagado de etileno kaj klorida acido:
Sintezo 3
[redakti | redakti fonton]- Preparado per trakatado de etanolo kaj klorida acido:
Sintezo 4
[redakti | redakti fonton]- Preparado per reakcio inter fluoroetano kaj kalcia klorido:
Sintezo 5
[redakti | redakti fonton]- Preparado per reakcio inter tionila klorido kaj etanolo:
Sintezo 6
[redakti | redakti fonton]- Preparado per reakcio inter etanolo kaj fosfora triklorido:
Sintezo 7
[redakti | redakti fonton]- Preparado per reakcio inter etanolo kaj fosfora kvinklorido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de kvaretila plumbo:
Reakcio 2
[redakti | redakti fonton]- Reakcio kun natria hidroksido:
Reakcio 3
[redakti | redakti fonton]- Reakcio kun acetileno
Reakcio 4
[redakti | redakti fonton]- Reakcio kun etileno
Reakcio 5
[redakti | redakti fonton]- Reakcio kun magnezio:
Reakcio 6
[redakti | redakti fonton]- Reakcio kun zinko en ĉeesto de klorida acido:
Reakcio 7
[redakti | redakti fonton]- Reakcio kun arĝenta nitrito:
Reakcio 8
[redakti | redakti fonton]- Reakcio kun amoniako
Reakcio 9
[redakti | redakti fonton]- Reakcio kun natria jodido:
Reakcio 10
[redakti | redakti fonton]- Reakcio kun natria hidrogena sulfido:
Literaturo
[redakti | redakti fonton]- Sigma Aldrich
- Laboratory Experiments for Introduction to General, Organic and Biochemistry
- Pharmaceutical Industry Practices on Genotoxic Impurities
- Computational Science
- Certain R-134a Coolant
- A Consumerýs Dictionary of Household, Yard and Office Chemicals
Vidu ankaŭ
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ Chemical Book
- ↑ Merck Millipore. Arkivita el la originalo je 2019-01-15. Alirita 2019-01-15.
- ↑ PubChem








![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)