Nitroacetata acido
| Nitroacetata acido | |||
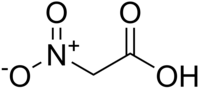 | |||
| Plata kemia strukturo de la Nitroacetata acido | |||
 | |||
| Tridimensia kemia strukturo de la Nitroacetata acido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 625-75-2 | ||
| ChemSpider kodo | 39723 | ||
| PubChem-kodo | 42581 | ||
| Fizikaj proprecoj | |||
| Aspekto | blanka solidaĵo | ||
| Molmaso | 105,049 g·mol-1 | ||
| Denseco | 1,523g cm−3 | ||
| Fandpunkto | 87°C-89°C[1] | ||
| Bolpunkto | 297,9°C[2] | ||
| Refrakta indico | 1,460 | ||
| Ekflama temperaturo | 150,6 °C | ||
| Acideco (pKa) | 1,68 | ||
| Sekurecaj Indikoj | |||
| Riskoj | R36/37/38 | ||
| Sekureco | S26 S36/37/39 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H302, H314, H332 | ||
| GHS Deklaroj pri antaŭgardoj | P260, P261, P264, P270, P271, P280, P301+312, P301+330+331, P303+361+353, P304+312, P304+340, P305+351+338, P310, P321, P330, P363, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Nitroacetata acido aŭ C2H3NO4 estas kemia kombinaĵo rezultanta el interagado de la acetata acido kaj nitrata acido en ĉeesto de sulfata acido. Ĝi estas blanka solidaĵo malmulte solvebla en akvo, solvebla en benzeno, tolueno kaj etanolo, tre solvebla en duetila etero kaj nesolvebla en "nafta etero".[3].
Nitroacetata acido estas danĝera antaŭaĵo por produktado de la nitrometano, ofte uzata kiel pelaĵo kaj organika reakciaĵo en kemiaj sintezoj. Saloj kaj esteroj de la nitroacetata acido estas konataj kiel nitroacetatoj kie metila nitroacetato kaj etila nitroacetato estas komerce disponeblaj. Kiel oni povas konstati, nitroacetata acido estas pli forta acido ol acetata acido. Rilate al reakcioj kun nitroacetato oni devas zorgi ĉar ĝi malrapide malkomponiĝas ĉe meditemperatuo en nitrometanon kaj karbonan duoksidon.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per interagado de aminoacetata acido kaj nitrita acido:
Sintezo 2
[redakti | redakti fonton]- Preparado per interagado de aminoacetata acido kaj nitrila klorido:
Sintezo 3
[redakti | redakti fonton]- Preparado per traktado de kloroacetata acido kaj nitrita acido:
Sintezo 4
[redakti | redakti fonton]- Preparado inter kloroacetata acido kaj AgNO2:
Sintezo 5
[redakti | redakti fonton]- Preparado per interagado de cianoacetata acido kaj nitrita acido:
Sintezo 6
[redakti | redakti fonton]- Preparado ekde la acetata acido kaj nitrata acido en ĉeesto de sulfata acido kun molekula rearanĝo:[4]
Sintezo 7
[redakti | redakti fonton]- Preparado per traktado de fenilacetata acido kaj nitrila klorido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Konvertado al aminoacetata acido:
Reakcio 2
[redakti | redakti fonton]- Konvertado al nitrometano:
Reakcio 3
[redakti | redakti fonton]- Konvertado al fenilacetata acido:
Reakcio 4
[redakti | redakti fonton]- Konvertado al bromoacetata acido:
Reakcio 5
[redakti | redakti fonton]- Konvertado al fluoroacetata acido:
Reakcio 6
[redakti | redakti fonton]- Konvertado al jodoacetata acido:
Reakcio 7
[redakti | redakti fonton]- Konvertado al cianoacetata acido:
Literaturo
[redakti | redakti fonton]- Pharmaceutical Process Chemistry
- March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure
- Dihydric Alcohols, Their Oxidation Products and Derivatives: A Modern ...
- Paraffins: Chemistry and Technology
- Thermochemical Data of Organic Compounds
- Organic Chemistry: Part I: Aliphatic Compounds
- Aliphatic Organic Chemistry
- Pharmaceutical Process Chemistry
Vidu ankaŭ
[redakti | redakti fonton]- Acetata acido
- Acetoacetata acido
- Bromoacetata acido
- Etilacetata acido
- Cianoacetata acido
- Etila nitroacetato
- Etila p-nitrobenzoato
- Fenilacetata acido
- Furanoacetata acido
- Aminoacetata acido
- Glikolata acido
- Butilacetata acido
- 2,2-Dumetilacetata acido
- Jodoacetata acido
- Kloroacetata acido
- Metila nitroacetato
- Metila p-nitrobenzoato
- Nitroacetaldehido
- Nitroaminofenolo
- Nitroanilino
- Nitroanizolo
- Nitrobarbiturata acido
- Nitrobenzaldehido
- Nitrobenzeno
- Nitrobenzenoacetata acido
- Nitrobenzenosulfonata acido
- Nitrobenzofenono
- Nitrobenzoila cianido
- Nitrobenzoila klorido
- Nitrodufenilamino
- Nitrofenilamino
- Nitrofenolo
- Nitrometano
- Nitropropanolo[5]
- Nitropropano
- Nitrosalikata acido
- Trimetilacetata acido
- Metilacetata acido
- Propila p-nitrobenzoato
- Propilacetata acido





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)


![{\displaystyle {\mathsf {{\xrightarrow[{}]{LiAlH_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa840d3a4e2fad508b60655cd1f846f6a41f16d6)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{80^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bb9792d1d0896d65ab8bfeac5156963c136fc68)