Trikloroacetata acido
| Trikloroetanata acido | |||||

| |||||
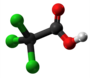
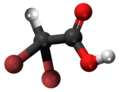
| Kemia strukturo de la Trikloroacetata acido | |||||

| |||||
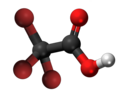
| 3D Kemia strukturo de la Trikloroacetata acido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 76-03-9 | ||||
| ChemSpider kodo | 1077205 | ||||
| PubChem-kodo | 6421 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | Senkoloraj aŭ blankaj kristaloj kun akra odoro | ||||
| Molmaso | 163.38 g mol−1 | ||||
| Smiles | ClC(Cl)(Cl)C(O)=O | ||||
| Denseco | 1.63 g/cm3 | ||||
| Refrakta indico | 1,62 | ||||
| Fandopunkto | inter 57 ĝis 58 °C (135 ĝis 136 ℉; 330 ĝis 331 K)[2] | ||||
| Bolpunkto | inter 196 ĝis 197 °C (385 ĝis 387 ℉; 469 ĝis 470 K)[2] | ||||
| Acideco (pKa) | 0,66 | ||||
| Mortiga dozo (LD50) | 5000 mg/kg (muso, buŝa) | ||||
| Merck Index |
| ||||
| Sekurecaj Indikoj | |||||
| Risko | R35 R50/53 | ||||
| Sekureco | S(S1/2) S26 S36/37/39 S45 S60 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H314, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P273, P280, P303+361+353, P304+340, P310, P305+351+338, P391 | ||||
Trikloroacetata acido, hidrogena trikloroetanato aŭ Cl3C-COOH estas analogo de acetata acido, kie tri hidrogenatamoj de la metila grupo (-CH3) estas anstataŭataj de kloratomoj.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per agado de kloro kaj acetata acido, en la ĉeesto de katalizilo:
Sintezo 2
[redakti | redakti fonton]- Produktado de trikloroacetata acido ekde la benzila triklorido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Neŭtraliga reakcio inter trikloroacetata acido kaj natria hidroksido:
Reakcio 2
[redakti | redakti fonton]- Trikloroacetata acido reakcias kun metanolo por doni la respektivan esteron:
Reakcio 3
[redakti | redakti fonton]- Trikloroacetata acido reakcias kun fenoloj en ĉeesto de sulfata acido por doni la respektivan esteron:
Uzoj
[redakti | redakti fonton]Ĝi estas vaste uzata en biokemio por precipitigo de makromolekuloj, tiaj kiaj proteinoj, DNA kaj RNA. Solvaĵoj enhavantaj trikloroacetata acido kiel ingredienco uzatas por kosmetikaj traktadoj, tiel kiel kemiaj haŭtoj, tatuo-forigo kaj traktado de haŭto-papilomoj, inklude de seksorganaj verukoj. Ĝi povas mortigi normalajn ĉelojn ankaŭ. Ĝi estas konsiderata sekura dum gravedeco.
Saloj kaj esteroj de trikloroacetata acido nomatas trikloroacetatoj. Ĝiaj natriaj saloj uzatis kiel herbicido en la 1950 jardeko, tamen la registaraj kontrolorganoj forigis ĝin el la merkato inter la 1980 jardeko kaj komenco de 1990.
Historio
[redakti | redakti fonton]La malkovro de trikloroacetata acido de Jean-Baptiste Dumas, en 1839, donis tranĉan impulson por la malrapida disvolviĝanta teorio pri organikaj radikaloj kaj valentoj. La teorio estis kontraŭa al la kredoj de Jöns Jacob Berzelius kaj longa disputo ekiĝis inter Dumas kaj Berzelius.
Literaturo
[redakti | redakti fonton]- Sigma Aldrich
- Centroj por Kontrolo kaj Preventado de Malsanoj
- Merck Millipore
- How Stuff Works
- Science Direct
- Chemical Book
Halogenidaj derivaĵoj de acetata acido
[redakti | redakti fonton]-
Trikloroacetata acido
| ||||||








![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)


![{\displaystyle {\mathsf {{\xrightarrow[{}]{H_{2}SO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a91dd08456a5acd28298697e8e92c1123b59ed37)

![{\displaystyle {\mathsf {{\xrightarrow[{Nitrila\;klorido}]{Kloramino}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/28173e6dd42a6d5d4bb8534d8a502d393fda3444)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{CrO_{3}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ccb2b493248ff6470db823effbee1fcc09102581)