Okzalata acido
| Okzalata acido | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| speco de kemia ento | ||||||||
| dikarboksilata acido • diprotic acid | ||||||||
| Ĝeneralaĵoj | ||||||||
| Nomo | Okzalata acido | |||||||
| Kemia formulo | H2C2O4 | |||||||
| CAS-numero-kodo | 144-62-7 | |||||||
| PubChem-kodo | 971 | |||||||
| ChemSpider-kodo | ||||||||
| SMILES |
C(=O)(C(=O)O)O
| |||||||
| Karakterizaĵoj | ||||||||
| Molmaso |
90.03 g·mol−1 | |||||||
| Denseco |
1.90 g cm−3 (anhidra) | |||||||
| Fandopunkto | ||||||||
| Solvebleco | 143 g/L (25 °C) | |||||||
| Sekurecaj indikoj | ||||||||
| ||||||||
| Se eble, uziĝu unuoj de la Sistemo Internacia de Unuoj. Escepte de la notoj alie indikitaj, la datumoj rilatas al materialoj laŭ la ordinaraj normoj pri temperaturo kaj premo (25o kaj premo je 1 atmosfero aŭ 760 mm de Hg). | ||||||||
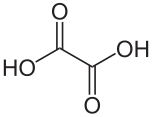
Okzalata acido[1] aŭ oksalata acido[2] estas organika kombinaĵo kies molekula formulo estas H2C2O4. Ĝi estas solida senkolora kristalo formante akvan senkoloran solvaĵon. Ĝi estas klasifikita kiel dukarboksilata acido. Rilate al acida forto ĝi estas pli forta ol la acetata acido. Okzalata acido estas reduktanta agento kaj ties konjuga bazo[3], konata kiel okzalata jono (C2O42−), estas kelata agento. Kutime, la okzalata acido nature troveblas en ties duhidratohava formo, H2C2O4.2 H2O. Troa konsumado de okzalata acido aŭ longedaŭra haŭtokontakto esteblas danĝera.
Preparado[redakti | redakti fonton]
Okzalata acido estas ĉefe produktita per oksidigo de karbonhidratoj aŭ glukozo uzante nitratan acidon aŭ aeron en la ĉeesto de vanada pentoksido (V2O5). Plurvariaj antaŭaĵoj estas uzeblaj inklude de glukolata acido kaj etileno-glikolo. Pli ĵusa metodo entenas oksidigan karbonizon[4] de alkoholoj produktante la duesterojn de la okzalata acido. Laŭ la ekvacio:
- 4 ROH + 4 CO + O2 → 2 (CO2R)2 + 2 H2O
Ĉi-duesteroj sekve estas hidrolizitaj al okzalata acido. Ĉiujare ĉirkaŭ 120 mil tunoj produktiĝas. Historie, la okzalata acido estis akirita ekskluzive de kaŭstikaĵoj samkiel natria aŭ kalia hidroksido sur segaĵon.
Laboratoriaj metodoj[redakti | redakti fonton]
Kvankam la okzalata acido estas facile akirebla, ĝi ankaŭ estas produktebla en laboratorio per oksidigo de la saĥarozo uzante nitratan acidon sub la agado de eta kvanto da vanada pentoksido kiel katalizilo. La hidratohava solido estas malhidratigita per varmo aŭ per azeotropa distilado[5]. Disvolviĝinta en Nederlando, iu elektrokatalizo per kupra komplekso helpas la reduktiĝon de la karbona duoksido en okzalatan acidon. Ĉi-konvertiĝo uzas karbonan duoksidon kiel kruda materialo por generi okzalatan acidon.
Historie, en 1824, Friedrich Wöhler (1800-1882) preparis okzalatan acidon per hidrolizo de cianogeno. Ĉi-eksperimento eble reprezentis la unuan sintezon de unu natura produkto.
Strukturo[redakti | redakti fonton]
Anhidra okzalata acido ekzistas kiel du polimorfoj[6]: en unu, la hidrogenaj ligiloj rezultas kiel ĉenosimila strukturo dum la alia modelo kun hidrogenaj ligiloj prezentas foliaspekta strukturo. Ĉar la anhidra materialo estas kaj acida kaj hidrofila, ĝi estas uzata en esterigajn reakciojn.
Reakcioj[redakti | redakti fonton]
La okzalata acido estas rilative forta protondonanto, malgraŭ esti iu karboksilata acido. Ĝiaj jonigaj koeficientoj estas la jenaj:
- C2O4H2 → C2O4H− + H+; pKa = 1.27
- C2O4H− → C2O42− + H+; pKa = 4.27
Okzalata acido suferas multajn el la karakterizaj reakcioj de aliaj karboksilataj acidoj. Ĝi formas esterojn tiel kiel la dimetilan okzalaton (fandpunkto 52,5 ĝis 53,5oC). Ĝi formas acidan kloridon nomatan klorido de okzalilo. Okzalato, la konjuga bazo de la okzalata acido, estas bonega liganto[7] por metalaj jonoj, ekzemple, la drogo Okzaliplatino[8]. La okzalata acido kaj la okzalatoj estas oksidigeblaj de permanganato per memkataliza reakcio.
Trovebleco[redakti | redakti fonton]
Biosintezo[redakti | redakti fonton]
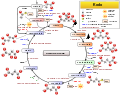
Ekzistas minimume du vojoj por la formiĝo enzimohelpa de la okzalato. En unu vojo, la okzaloacetato, unu komponanto de la Ciklo de Krebs por la Citrata acido, hidroliziĝas al okzalato kaj acetata acido per la enzimo okzaloacetazo[9], laŭ la reakcio jena:
[O2CC(O)CH2CO2]2− + H2O → C2O42− + CH3CO2−
Ĝi ankaŭ produkteblas per malhidrogenizado[10] de la glukokola acido[11], kiu produktiĝas per la metabolismo de la glikola etileno[12].
Okzalata acido en plantoj kaj manĝaĵoj[redakti | redakti fonton]
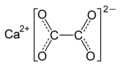
Kalcia okzalato estas la plej ordinara komponanto de la renoŝtonoj. La unuaj esploristoj izolis la okzalatan acidon el la oksalidoj. Membroj de la spinacaj familioj kaj la brasikoj (Blanka brasiko, Brokolo kaj Burĝonbrasiko) enhavas altajn amasojn da okzalatoj, samkiel la Apiacoj kiel Petroselo kaj Okzalo. Folioj de rabarboj (Rheum rhabarbarum) enhavas ĉirkaŭ 0,5% da okzalata acido kaj la arizemo[13] enhavas kristalojn da kalcia okzalato. Kelkaj bakterioj produktas okzalatojn per oksidigo de karbonhidratoj. Plantoj el la genro Fenestraria[14] produktas optikajn fibrojn faritaj el kristalecaj okzalataj acidoj por konduki la lumon al subteraj fotosintezaj stacioj.
Oksidigita asfalto aŭ asfalto sub la agado de la gamaj radioj ankaŭ enhavas okzalatan acidon inter ties malkomponiĝaj produktoj. La okzalata acido plifortigeblas la filtradon de radioaktivaj izotopoj kondiĉitaj sub asfalto por eliminado de radioaktiva rubaĵo[15].
Biokemio[redakti | redakti fonton]
La konjuga bazo de la okzalata acido estas potenca inhibicianto de la enzimo Laktata malhidrogenazo (LDH)[16]. La enzimo LDH katalizas la konvertiĝon de la piruvato al laktata acido (finprodukto de la procezo pri senoksigena fermentigo oksidiganta la kunenzimon NADH al NAD+ kaj H+ samtempe. La restarigado de la niveloj de NAD+ estas esenca por la kontinueco anaeroba energia metabolismo per la glukozo. Ĉar la kanceraj ĉeloj prefere uzas la anaeroban metabolismon, la inhibicio de la LDH, estas elmontrita por inhibicii la formadon kaj kreskadon de la tumoro (Efekto Warburgo), tiamaniere ke tio estas interesa kaj potenca procedo por la kontraŭkancera traktado.
Ĉirkaŭ 25% de la okzalata acido produktita uzatas kiel mordanto[17] en tinkturaj procezoj[18]. Ĝi ankaŭ estas uzata kiel blankigilo[19], ĉefe al traktado de papero kaj lignopulpo[20].
La ĉefaj aplikoj de la okzalata acido inkluzivas purigadon kaj blankigon, specilae rilate al forigo de rustaĵoj (kiel kompleksiganta feraganto). En Usono ordinare troveblas dompurigilon enhavantan okzalatan acidon[21]. Ĝi uzatas kiel rustoforiga aganto ĉar ĝi formas akvosolveblan salon kun ferika jono: la jono ferriokzalato[22].
Okzalata acido estas grava reakcianto pri la lantanida kemio. Lantanaj okzalatoj hidratohavaj rapide formas facile solveblaj acidaj solvaĵoj, en dense kristalecaj, facile filtreblaj formoj, komplete senaj je malpuraĵoj kun nelantanidaj elementoj. Varma malkomponiĝo de ĉi-okzalatoj produktas oksidojn, kiuj estas la plej ordinare komerceblaj formoj de ĉi-elementoj.
Solvaĵoj kun vaporoj de okzalata acido je 3,2% en sukersiropo uzatas de kelkaj abelkulturistoj kiel akaricido kontraŭ la "Varroa destructor"[23][24].
Okzalata acido frotiĝas sur marmoraj skulptaĵoj por doni iom da brilo kaj kompleta sigelo de la surfaco. Okzalata acido ankaŭ uzeblas por elimini ferajn kaj manganajn deponejojn sur la kvarcaj kristaloj. Oni povas ankaŭ uzi okzalatan acidon kiel lignoblankigilo, forigante nigrajn makulojn pro la akvopenetrado.
Tokseco kaj sekureco[redakti | redakti fonton]
Okzalata acido havas toksajn efektojn per la kontakto kaj kiam ingestita. Ĝi ne estas identigita kiel mutaciiga agento kaj kancerigo-karaktera. Ekzistas la riskon je denaska malformiĝo de la feto kaj ĝi eble danĝeras kiam inhalita, estas ekstreme detruiga al la histoj de la mukoza membrano de la supera spiraparataro; danĝera kaj detruiga al la histoj kaj kaŭzas brulvundojn kiam absorbita de la haŭto aŭ ĉe la okulkontakto. Simptomoj kaj efektoj inkluzivas brulosensacion, tusado, kapturno, laringoinflamo, aermanko, spasmo, laringedemo, inflamo kaj edemo de la bronkoj, pulminflamo kaj pulmedemo.
En homoj, la okzalata acido ingestita havas minumuman Mortodozon (LD) je 600 mg/kg. Raportoj konfirmas ke la buŝa mortodozo estas inter 15 kaj 30 gramoj.
La tokseco de la okzalata acido rezultas en la rena fiasko kaŭzata de precipitaĵo de kalcia okzalato, la ĉefa komponanto de la galŝtonoj. Okzalata acido ankaŭ povas kaŭzi artralgion pro la formiĝo de similaj precipitaĵoj en la artikoj. Ingestado de etilena glikolo rezultas je okzalata acido kiel metabolito kiu ankaŭ kaŭzeblas akutan renfiaskon.
Enhavo de okzalata acido en la manĝaĵoj[redakti | redakti fonton]
| Vegetalo | Bildoj | Okzalata acido (g/100 g) |
Vegetalo | Bildoj | Okzalata acido (g/100 g) |
|---|---|---|---|---|---|
| Ajlo |  |
Kukumo |  |
||
| Akvokreso |  |
Kukurbo | |||
| Amara cikorio |  |
Laktuko | |||
| Amaranto | Spinaco |  |
|||
| Asparago |  |
Manioko |  |
||
| Batato | Melongeno |  |
|||
| Blanka brasiko | Napo | ||||
| Brokolo | Pastinako |  |
|||
| Burĝonbrasiko |  |
Petroselo |  |
||
| Cepo |  |
Portulakacoj | |||
| Endivio | Rabarbo (folioj) | ||||
| Verda fabo, Fazeolo |  |
Rafaneto |  |
||
| Florbrasiko |  |
Rapo | |||
| Verda brasiko | Ruĝa beto folioj | ||||
| Gombo | Ŝenoprazo |  |
|||
| Ĝardena pizo |  |
Sukermaizo | |||
| Kapsiko |  |
Terpomo | |||
| Karoto | Tomato | ||||
| Koriandro |  |
Vera celerio |  |
||
| Krispa brasiko |  |
Kombinaĵoj[redakti | redakti fonton]
Vidu ankaŭ[redakti | redakti fonton]
-
Glukolata acido -
Etileno-glikolo -
Vanada pentoksido -
Cianogeno -
Oksaliplatino -
Hans Adolf Krebs
(1900-1981) -
Glikola etileno -
Friedrich Wöhler
(1800-1882)
Referencoj[redakti | redakti fonton]
- ↑ Nova Plena Ilustrita Vortaro de Esperanto: okzalata acido
- ↑ Nova Plena Ilustrita Vortaro de Esperanto: oksalato, variaĵo de okzalato
- ↑ Organic Chemistry: An Introduction Emphasizing Biological Connections ..., I. David Reingold
- ↑ La oksidiga karbonizo rilatas al reakcioj enkondukantaj monooksida karbono en organikajn aŭ neorganikajn substratojn.
- ↑ Special Distillation Processes, Zhigang Lei, Biaohua Chen, Zhongwei Ding
- ↑ One Chemistry, Two Continents: Function and Maintenance of Chemical ... Arkivigite je 2015-04-02 per la retarkivo Wayback Machine, Kenneth Michael Keefover-Ring
- ↑ Encyclopædia Britannica
- ↑ Chemocare. Arkivita el la originalo je 2015-03-12. Alirita 2015-03-04.
- ↑ Advances in Fungal Biotechnology for Industry, Agriculture, and Medicine, Jan S. Tkacz, Lene Lange
- ↑ Next-Generation Batteries and Fuel Cells for Commercial, Military, and Space ..., A.R. Jha.
- ↑ Growing Younger: Breakthrough Age-defying Secrets for Women, Bridget Doherty, Julia VanTine
- ↑ How to Start a Ethylene Glycol (excluding Anti-freeze Mixtures) Business ... Arkivigite je 2015-04-02 per la retarkivo Wayback Machine, Makeda Housley
- ↑ El Rincón de las Ratas.
- ↑ Cactus-art-biz
- ↑ EPJ Web of Conferences
- ↑ Kidshealth.org
- ↑ Encyclopedia.com
- ↑ Encyclopædia Britannica
- ↑ Chemistry Explained
- ↑ Encyclopedia.com
- ↑ Bar Keepers Friend
- ↑ ChemBlink
- ↑ Encyclopædia Britannica
- ↑ Exploring New Methods for Varroa Mite Control Arkivigite je 2015-04-02 per la retarkivo Wayback Machine, Yu-Lun Lisa Fu