Malario
| Malario | |
|---|---|
| endemic disease • malsano | |
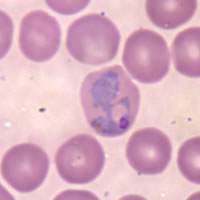
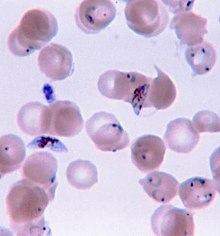
| Eritrocitoj infektitaj de P.vivax | |
| KIM-10 | B50-B54 |
| Statistikaj indikoj – ambaŭ seksoj[1] | |
| Maksimumo de apero | sub 5 jaroj |
| Klinika bildo | |
| Kaŭzoj aŭ riskaj faktoroj |
plasmodio |
Malario aŭ marĉofebro (aŭ ankoraŭ alinomita paludismo) estas moskito-transdonita infekta malsano de homoj kaj aliaj bestoj, kaŭzataj de parazitaj protozooj (grupo de unu-ĉelaj mikroorganismoj), kiuj apartenas al la genro plasmodio.[2] Malario kaŭzas simptomojn kiuj tipe inkluzivas febron, lacecon, vomadon, kaj kapdoloron. En severaj kazoj, ĝi povas kaŭzi ikteron, konvulsion, aŭ morton.[3] Simptomoj plej ofte komencas inter dek kaj dek kvin tagoj post pikiĝo. Sen ĝusta kuracado, homoj povas remalsaniĝi post pluraj monatoj.[2] Ĉe tiuj, kiuj lastatempe travivis infektiĝon, reinfektiĝo plej ofte kaŭzas malpli fortajn simptomojn. Ĉi tiu parta rezistemeco malaperas dum monatoj aŭ jaroj se la homo ne daŭre kontaktas malarion.[3]
Malario estas kaŭzata de kvin specioj de plasmodioj[4]:
La malsanon plej ofte transdonas infektita ina Anofelesa moskito (kulo). La moskito-piko metas la parazitojn de la salivo de la moskito en la sangon de homo.[2] La parazitoj vojaĝas al la hepato, kie ili maturiĝas kaj reproduktiĝas. Kvin specioj de Plasmodium povas infekti homojn, kaj per homoj povas disvastiĝi.[3] La plimulto da mortoj kaŭziĝas de P. falciparum, ĉar P. vivax, P. ovale, kaj P. malariae ĝenerale kaŭzas pli mildan formon de malario.[2][3] La specio P. knowlesi malofte kaŭzas malsanon ĉe homoj.[2] Malario tipe diagnoziĝas per mikroskopa ekzameno de sango per sango-tavoloj, aŭ per rapidaj diagnozaj ekzamenoj surbaze de antigenoj.[3] Rimedoj, kiuj utilas la polimerazan ĉen-reakcion por detekti la DNA-on de la parazito, disvolviĝis, sed ne vaste utiliĝas en lokoj kie malario estas ofta, pro sia kosto kaj malsimpleco.
La risko de malsaniĝo povas esti malpliigita per la malhelpo de moskito-pikiĝo per utilo de kulvualoj (kontraŭ-moskitaj vualoj) kaj insekt-forpelaj substancoj, aŭ per moskito-regaj rimedoj, kiel la ŝprucado de insekticidoj, kaj la forfluigo de senmova akvo.[3] Pluraj medikamentoj estas disponeblaj por malhelpi malarion ĉe vojaĝantoj al regionoj, kie la malsano oftas. Porokazaj dozoj de la medikamento sulfadoksino/pirimetamino rekomendiĝas ĉe novnaskitoj, kaj post la unua trimestro de gravediĝo en lokoj, kun altaj niveloj de malario. Malgraŭ la bezono, neniu efika vakcino ekzistas, kvankam klopodoj krei vakcinon daŭras.[2] La rekomendata kuracado por malario estas kombinaĵo de kontraŭmalariaj medikamentoj, kiuj enhavas artemisininon.[2][3] La dua medikamento povas esti aŭ meflokino, aŭ lumefantrino, aŭ sulfadoksino/pirimetamino.[5] Kinino, kune kun doksiciklino, povas uziĝi se artemisinino ne haveblas.[5] Oni rekomendas, ke en regionoj, kie la malsano oftas, oni certiĝu, ke temas pri malario, antaŭ ol komenci kuracadon, por eviti la pliigon de kontraŭ-droga rezistemeco. Rezistemeco inter la parazitoj evoluiĝis kontraŭ pluraj kontraŭmalariaj medikamentoj; ekzemple, klorokino-rezistema P. falciparum disvastiĝis al la plimulto de malario-havaj regionoj, kaj rezistemeco kontraŭ artemisinino fariĝis problemo en kelkaj partoj de Suda Azio.[2]
La malsano disvastiĝis en la tropkiaj kaj subtropikaj regionoj, kiuj ekzistas en vasta strio ĉirkaŭ la ekvatoro.[3] Ĉi tiu enhavas grandajn partojn da Subsahara Afriko, Azio, kaj Latin-Ameriko. En 2015, estis 214 milionoj da kazoj de malario en la tuta mondo.[6] Oni taksas, ke ĉi tiu rezultis en 438 000 mortoj, 90% el kiuj okazis en Afriko.[6] Malsano-niveloj malpliiĝis de 2000 ĝis 2015 per 37%,[6] sed pliiĝis de 2014, dum kiu estis 198 milionoj da kazoj.[7] Malario ofte ligiĝas kun malriĉeco, kaj havas imponan malhelpan efikon ĉe ekonomia disvolviĝo.[8][9] En Afriko, oni taksas, ke ĝi kaŭzis perdojn de 12 bilionoj da usonaj dolaroj jare pro pliigitaj publik-sanaj elspezoj, perdita labor-kapablo, kaj malhelpaj efikoj ĉe turismo.[10]
Signoj kaj simptomoj[redakti | redakti fonton]
La signoj kaj simptomoj de malaria tipo komenciĝas inter 8 kaj 25 tagoj post infektiĝo;[11] tamen, simptomoj povas okazi pli malfrue en tiuj, kiuj ricevis kontraŭmalariajn medikamentojn.[12] Unuaj signoj de la malsano, komunaj al ĉiuj malario-specioj, similas tiujn de gripo,[13] kaj povas esti similaj al tiuj de aliaj malsanoj, kiel ekzemple sepso, gastroenterito, kaj virusaj malsanoj.[12] La prezentiĝo povas inkluzivi kapdoloron, febron, tremadon, artiko-doloron, vomadon, hemolitan anemion, ikteron, hemoglobinon en la urino, damaĝon al la retinoj, kaj konvulsadojn.[14]
La plej karakteriza simptomo de malario estas paroksismo—ciklo de subita malvarmumo sekvita de tremado, kaj poste febro kaj ŝvitado, kiu reokazas je ĉiuj du tagoj, (terciana febro) en infektiĝoj de P. vivax kaj P. ovale, kaj je ĉiuj tri tagoj (kvartana febro) por P. malariae. Infektiĝo per P. falciparum povas kaŭzi febron, kiu reokazas post ĉiuj 36–48 horoj, aŭ malpli notebla kaj pli konstanta febro.[15]
Serioza malario ĝenerale kaŭziĝas de P. falciparum (ofte nomata falciparum-a malario). Simptomoj de falciparum-a malario aperas 9–30 tagojn post infektiĝo.[13] Personoj kun cerba malario ofte montras neŭrologiajn simptomojn, kiuj inkluzivas nenormalan pozadon/korpotenadon, nistagmon, kunjungan vido-paraliziĝon (en kiu la okuloj ne turnas kune al la sama direkto), troan etendiĝon kaj spasmon de la kolo kaj dorso, konvulsiojn, aŭ komaton.[13]
Komplikiĝoj[redakti | redakti fonton]
Malario havas plurajn seriozajn komplikiĝojn. Inter tiuj estas la okazo de malfacila spirado, kiu okazas en ĝis 25% de plenkreskuloj kaj 40% de infanoj kun severaj P. falciparum-a malario. Eblaj kaŭzoj inkluzivas spiran kompensadon por metabola acidozo, edemon ĉe la maldekstra pulmo, rezistantan pneŭmonion, kaj severan akompanantan anemion. Malgraŭ tio, ke ĝi estas malofta ĉe junaj infanoj kun severa malario, severa spir-malfacila sindromo okazas en 5–25% de plenkreskuloj kaj ĝis 29% de gravedaj virinoj.[16] Samtempa infektiĝo per HIV kun malario pligradigas la eblecon de morto.[17] Rena misfunkciiĝo estas trajto de hemoglobinurio, en kiu hemoglobino de rompitaj eritrocitoj tralikiĝas en la urinon.[13]
Infektiĝo pro P. falciparum povas okazigi cerban malarion, nome formo de severa malario kiu afektas la cerbon. Ĝi asocias kun retino-blankiĝo, utila signo por distingi malarion disde aliaj kaŭzoj de febro.[18] Lieno-grandiĝo, severa kapdoloro, hepato-grandiĝo, hipoglikemio, kaj hemoglobinurio kun rena misfunkcio povas okazi.[13] Komplikiĝoj povas inkluzivi spontanan sangadon kaj nekoagulemon. Povas kaŭzi ikton.[19]
Malario ĉe gravedaj virinoj estas grava kaŭzo de feta morto, infanmortiĝo, aborto, kaj malalta pezo je naskiĝo aŭ antaŭfrua nasko,[20] precipe en kazo de infektiĝo de P. falciparum, sed ankaŭ ĉe P. vivax.[21]
Kaŭzo[redakti | redakti fonton]
Vidu ankaŭ la artikolon Plasmodio.
Malariaj parazitoj apartenas al la genro Plasmodio (filumo Apikomplekso). Ĉe homoj, malarion kaŭzas P. falciparum, P. malariae, P. ovale, P. vivax kaj P. knowlesi.[22][23] Ĉe la infektitoj, P. falciparum estas la specio plej ofte trovata (~75%), sekvata de P. vivax (~20%).[12] Malgraŭ ke P. falciparum tradicie respondecas pri la plimulto da mortoj,[24] lastatempaj pruvoj sugestas, ke P. vivax malario ligiĝas kun kondiĉoj, kiuj povas minaci la vivon, preskaŭ same ofte, kiel kun diagnozo de infektiĝo per P. falciparum.[25] P. vivax estas pli ofta ekster Afriko.[26] Estis registritaj kazoj de infektiĝo de pluraj specioj de Plasmodio de simioj; tamen, krom P. knowlesi-specio zoonoza, kiu kaŭzas malarion en makakoj[23]—ĉi tiuj estas plejparte ne tiom gravaj de vidpunkto de publika sano.[27]
Tutmonda varmiĝo verŝajne efikos la transiĝon de malario, sed la severeco kaj geografia distribuiĝo de tiaj efikoj estas necertaj.[28][29]
Vivo-ciklo[redakti | redakti fonton]
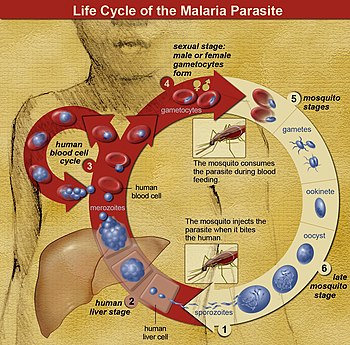
En la vivo-ciklo de Plasmodio, ina Anofelesa moskito (la unua mastro) plusendas movan infektan formon (nomata sporozoito) en la vertebrulan mastron, kiel ekzemplo homo (dua mastro), tiel iĝanta peranto de la infektiĝo. Sporozoito vojaĝas tra la sangaj vaskuloj al hepato-ĉelojn (hepatocitojn), kie ĝi reproduktiĝas sensekse (hista skizogonio), produktanta milojn da merozoitoj. Ĉi tiuj infektas novajn eritrocitojn, kaj komencigas novan serion de senseksaj multobliĝo-cikloj (sango-skizogonio) kiu produktas 8 ĝis 24 novajn infektopovajn merozoitojn. Tiam la ĉeloj rompiĝas kaj la ciklo rekomencas.[30]
Aliaj merozoitoj iĝas gametocitoj, kiuj estas la antaŭuloj de viraj kaj inaj gametoj. Kiam fekundigita moskito mordas, ĝi enprenas gametocitojn kune kun la sango, kiuj maturiĝas en ĝia intesto. La viraj kaj inaj gametocitoj unuiĝas, kaj formas oociton—fekundigitan, moveman zigoton. Oocitoj iĝas novaj sporozitoj, kiuj migras al la salivaj glandoj de la insekto, pretaj por infekti novan vertebrulan mastron. La sporozitoj injektiĝos en la haŭto, en la salivo, kiam la moskito sekve suĉas sangon.[31]
Nur inaj moskitoj suĉas sangon; viraj moskitoj suĉas plantan sukon, kaj ne transdonas la malsanon. La inoj de la Anofela genro de moskito preferas manĝi nokte. Ili plej ofte komencas la serĉon por manĝaĵo ĉe vesperiĝo, kaj daŭras la serĉadon dum la nokto ĝis kiam ili manĝos.[32] Je maloftaj okazoj, malariaj parazitoj ankaŭ povas esti transdonitaj per sango-transfuzo.[33]
Reokazanta malario[redakti | redakti fonton]
Simptomoj de malario povas reokazi post sensimptomaj tempoj. Depende de la kaŭzo, oni nomas la reokazon aŭ reintenisĝo, refalo, aŭ reinfektiĝo. Reintensiĝo estas la reveno de simptomoj post sensimptoma tempo. Ĝin kaŭzas parazitoj, kiuj supervivis en la sango pro sensufiĉa aŭ senefika kuracado.[34] Refalo okazas, kiam simptomoj reaperas post kiam la parazitoj eliminiĝis de la sango, sed restas kiel neaktivaj hipnozitoj en hepato-ĉeloj. Refalo ofte okazas inter 8 kaj 24 semajnoj, kaj ofte vidiĝas ĉe infektiĝoj de P. vivax kaj P. ovale.[12] P. vivax malario-kazoj en lokoj kun modera klimato ofte rezultas de dumvintra senaktiviĝo de la hipnozitoj, kun refaloj okazantaj dum la jaro post la moskito-pikiĝo.[35] Reinfektiĝo signifas, ke la parazito, kiu kaŭzis la pasintan infektiĝon eliminiĝis de la korpo, sed nova parazito enmetiĝis. Oni ne facile distingas inter reinfektiĝo kaj reintensiĝo, sed ĝenerale supoziĝas, ke reokazo de infektiĝo dum du semajnoj post kuracado por la unua infektiĝo okazas pro malsukceso de kuracado.[36] Homoj povas iom imuniĝi post oftaj infektiĝoj.[37]
Patofiziologio[redakti | redakti fonton]
Malario-infektiĝo disvolviĝas en du stadioj: unu ĉe la hepato (eksoeritrocita stadio), kaj alia ĉe la ruĝaj sango-ĉeloj (eritrocita stadio). Kiam infektita moskito rompas la haŭton por suĉi sangon, sporozoitoj en la salivo de la moskito eniras la sangofluon, kaj migras al la hepato, kie ili infektas hepatocitojn, kaj sekse reproduktadas dum 8 ĝis 30 tagoj. Simptomoj ne evidentiĝas dum ĉi tiu tempo.[38]
Post ebla senaktiva tempo en la hepato, ĉi tiuj organizoj diferenciĝas por krei milojn da merozoitoj, kiuj, post rompiĝo de siaj mastroĉeloj, eskapas en la sango-fluon kaj infektas ruĝajn sango-ĉelojn por komenci la eritrocitan stadion de la vivo-ciklo.[38] La parazito eskapas de la hepato sen detektiĝo volvante sin en la ĉelo-membrano de la infektata mastra hepato-ĉelo.[39]
En la ruĝaj sango-ĉeloj, la parazitoj plue multobliĝas, denove sensekse, foje elrompante el la mastro-ĉeloj por invadi novajn ruĝajn sango-ĉelojn. Pluraj tiaj multobliĝaj cikloj okazas. Tiel, kutimaj priskriboj de febro-ondoj okazas pro la samtempaj eskapoj de ondoj da merozoitoj, kiuj infektas ruĝajn sango-ĉelojn.[38]
Kelkaj P. vivax sporozoitoj ne tuj volviĝas al merozoitoj eksoeritrocito-stadiaj, sed anstataŭe produktas hipnozoitojn, kiuj restas senaktive dum tempoj inter pluraj monatoj (tipe 7 ĝis 10 monatoj) ĝis pluraj jaroj. Post senaktiva periodo, ili reaktiviĝas kaj produktas merozoitojn. Hipnozoitoj kaŭzas longan koviĝon kaj malfruaj reokazoj ĉe infektiĝoj per P. vivax,[35] malgraŭ ilia ĉeesto en kazoj de infektiĝo per P. ovale estas necerta.[40]
La parazito estas pli-malpli bone protektata de atako fare de la imuna sistemo de la homa korpo, ĉar dum la plimulto de sia vivo-ciklo ĝi vivas ene de la hepato- kaj sango-ĉeloj kaj estas pli-malpli netuŝebla de la imunsistema kontrolo. Tamen, cirkuliĝantaj infektitaj sango-ĉeloj detruiĝas en la lieno. Por eviti ĉi tiun faton, la parazito P. falciparum montras alkroĉemajn proteinojn ĉe la surfaco de la infektitaj ruĝaj sango-ĉeloj, kiu igas la sango-ĉelojn alkroĉi al la muroj de malgrandaj sangovaskuloj, tiel protektanta la paraziton de trapaso de la ĝenerala sango-cirkulo kaj la lieno.[41] Bariĝo de la vaskuletoj kaŭzas simptomojn, kiel tiuj de placenta malario.[42] Apartigitaj ruĝaj sango-ĉeloj povas trapasi la barilon inter la sango kaj la cerbo, kaj kaŭzi cerban malarion.[43]
Gena rezistokapablo[redakti | redakti fonton]
Laŭ recenzo farita en 2005, pro la granda nombro da mortoj kaj granda mortigemo de malario, precipe pro la specio P. falciparum, ĝi faris ĉe la homa genaro la plej grandan selektan premon en lastatempa historio. Pluraj genaj faktoroj donas kelkan rezisto-kapablon al ĝi. Inter ili estas serpoĉela trajto, talasemiaj trajtoj, nesufiĉeco de glukozo-6-fosfata duhidrogenazo, kaj la malĉeesto de Duffy antigenoj ĉe ruĝaj sango-ĉeloj.[44][45]
La efiko de serpoĉela trajto ĉe imuneco al malario montras kelkajn evoluciajn ŝanĝojn, kiuj okazis en kelkaj lokoj pro la ofteco de malario. Serpoĉela trajto ŝanĝas la hemoglobinan molekulon en la sango. Normale, ruĝaj sango-ĉeloj havas tre flekseblan, duflanke kavan strukturon, kiu permesas, ke ili movu tra malvastaj vaskuletoj; tamen, kiam la ŝanĝitaj hemoglobinaj molekuloj trovas malgrandajn kvantojn da oksigeno, aŭ ariĝas pro senakviĝo, ili povas kungluiĝi, formante ĉenojn, kiuj serpigas la ĉelon (misformigas ĝin en kurban formon). En ĉi tiuj ĉenoj, la molekulo ne tiom kapable prenas aŭ lasas oksigenon, kaj la ĉelo ne estas sufiĉe fleksebla por libere cirkuliĝi. Ĉe la fruaj stadioj de malario, la parazito povas kaŭzi serpiĝon ĉe ruĝaj sango-ĉeloj, tiel ke ili pli frue ĉesas cirkuliĝi. Pro tio, malariaj parazitoj malpli ofte povas fini sian vivo-ciklon en la ĉelo. Homoj, kies ĉeloj enhavas du kopiojn de la nenorma hemoglobina alelo (kiuj estas samzigotaj), havas serpoĉelan anemion, dum tiuj, kies ĉeloj portas unu norman kaj unu nenorman alelon (homoj malsamzigotaj), havas rezistokapablon kontraŭ malario, sen severa anemio. Malgraŭ ke la malpli longa vivodaŭro de tiuj kun la samzigota kondiĉo emus malfavori la supervivon de la trajto, en lokoj, kie malario oftas, la trajto konserviĝas pro la avantaĝoj, kiujn donas la malsamzigota formo.[45][46]
Hepata misfunkcio[redakti | redakti fonton]
Hepata misfunkcio pro malario estas malofta, kaj ĝenerale okazas nur ĉe tiuj, kiuj havas aliajn hepatajn malsanojn kiel virusa hepatozo aŭ longtempa hepata malsano. La sindromon oni foje nomas malaria hepatozo.[47] Malgraŭ tio, ke oni konsideras ĝin malofta, malaria hepato-malsano lastatempe plioftiĝis, ĉefe en Suda Azio kaj Barato. Hepata misfunkcio ĉe homoj, kiuj havas malarion, montras sisteman ligon kun pli granda ebleco de komplikiĝoj kaj morto.[47]
Diagnozo[redakti | redakti fonton]
Pro la nespecifa eco de la prezentiĝo de simptomoj, diagnozo de malario ĉe lokoj, en kiu la malsano maloftas, necesas altan nivelon de suspektemo, kiu povas okazi pro iu ajn el la sekvaj kialoj: lastatempa vojaĝado al lando, kie malario oftas, pligrandiĝinta lieno, febro, malalta nombro da plateletoj en la sango (trombocitopenio) kune kun normala nivelo de blankaj sango-ĉeloj (leŭkocitoj).[12]
La ĉeeston de malario oni ĝenerale konfirmas per la mikroskopa ekzameno de sango-tavoloj aŭ per antigen-detektaj provoj surbaze de antigenoj (RDT laŭ ĝia anglalingva akronimo).[48][49] Mikroskopa ekzameno estas la plej ofte uzata rimedo por detekti la malarian paraziton; ĉirkaŭ 165 milionoj da sangotavoloj ekzameniĝis por malarion en 2010[50] Malgraŭ ĝia multloka uzado, diagnozo per mikroskopa ekzameno havas du ĉefajn malavantaĝojn: ĉe multaj lokoj (precipe neurbaj) mankas la aparataro necesa por fari la ekzamenon, kaj la ĝusteco de la rezultoj dependas kaj de la kapablo de la ekzamenanto la sango-tavolon, kaj de la niveloj de la parazito en la sango. La precizo de la sango-tavola ekzamenado troviĝas inter 75-90% sub la plej bonaj kondiĉoj, kaj povas esti pli malalta ĝis 50%. Komerce disponeblaj provoj ofte montras pli precize ol sango-tavoloj la ĉeeston de malariaj parazitoj, sed ilia detektokapablo estas ege malsamaj, depende de la fabrikinto, kaj ne povas montri, kiom da parazitoj ĉeestas.[50]
En regionoj, kie laboratoriaj provoj facile disponeblas, malario suspektiĝu, kaj la provo fariĝu, ĉe iu ajn malsanulo, kiu estis en loko, kie malario estas ofta. Ĉe lokoj, kiuj ne havas la pagokapablojn por la laboratoriaj diagnozaj provoj, oni ofte uzas nur la historion de febro por indiki, ke kontraŭmalaria kuracado taŭgas, tiel la ofta diraĵo "febro egalas malarion sen kontraŭa pruvo". Malavantaĝo de ĉi tiu praktiko estas la tro-ofta diagnozado de malario kaj miskuracado de nemalaria febro, kiu malŝparas limigitajn rimedojn, erodas fidemon en la san-sistemo, kaj kontribuas al la malpli-efikigo de drogoj.[51] Malgraŭ ke provoj surbaze de polimeraz-ĉenaj reagoj kreiĝis, je 2012 oni ne multe uzas ilin ĉe lokoj, kie malario estas ofta, pro ilia malsimpleco.[12]
Klasifikiĝo[redakti | redakti fonton]
Malarion oni klasifikas kiel aŭ "severa" aŭ "senkomplika" de la Monda San-Organizo (WHO laŭ ĝia angla-lingva akronimo).[12] Oni taksas ĝin "severa" se iu ajn el la sekvaj kriterioj ĉeestas. Se neniu el la kriterioj ĉeestas, oni konsideras ĝin senkomplika.[52]
- Malpliiĝo de konscio
- Notinda malforto tiel, ke la homo ne povas piediri
- Nekapablo manĝi
- Du aŭ pli konvulsioj
- Malalta sangopremo (malpli ol 70 mmHg ĉe plenkreskuloj kaj 50 mmHg ĉe infanoj)
- Malfacila spirado
- Sangocirkuliĝa ŝoko
- Hepata misfunkcio aŭ hemoglobino ĉe la urino
- Problema sangado aŭ hemoglobino-kvanto malpli ol 50 g/L (5 g/dL)
- Pulma edemo
- Glukozo-nivelo en la sango je malpli ol 2.2 mmol/L (40 mg/dL)
- Acidodozo aŭ niveloj de lakta acido pli ol 5 mmol/L
- Pli ol po 100 000 parazitoj mikrolitre (µL) en la sango en lokoj, en kiuj malario malpli oftas, kaj po 250 000 mikrolitre en lokoj, kie malario oftas.
Cerba malario difiniĝas kiel severa P. falciparum-a malario, kiu prezentiĝas kun neŭrologiaj simptomoj, kiuj inkluzivas komaton (kun Glasgova komato-gamo je malpli ol 11, aŭ Blantira komato-gamo pli ol 3), aŭ kun komato, kiu daŭras pli longe ol 30 minutoj post konvulsio.[53]
| Nomo | Infekta agento | Notoj |
|---|---|---|
| alga malario | Plasmodium falciparum | severa malario, kiu efikiĝas ce la kardiovaskula sistemo kaj kaŭzas malvarmumon kaj kardiovaskula malfunkcio |
| gala malrio | Plasmodium falciparum | severa malario, kiu efikas ĉe la hepato kaj kaŭzas vomadon kaj ikteron |
| cerba malario | Plasmodium falciparum | severa malario, kiu efikas ĉe la cerbo |
| denaska malario | varia plasmodia | plasmodio transdonita de la patrino per la feta vaskula sistemo |
| falciparum-a malario, Plasmodium falciparum malario, pereiga malario | Plasmodium falciparum | |
| ovale malario, Plasmodium ovale malario | Plasmodium ovale | |
| kvartana malario, malariae malario, Plasmodium malariae malario | Plasmodium malariae | paroksismoj je ĉiu kvara tago (kvartana); la tago de la unua okazo kalkuliĝas kiel la unua tago. |
| ĉiutaga malario | Plasmodium falciparum, Plasmodium vivax | ĉiutagaj paroksismoj |
| terciana malario | Plasmodium falciparum, Plasmodium ovale, Plasmodium vivax | paroksismoj je ĉiu tria tago (terciana); la tago de la unua okazo kalkuliĝas kiel la unua tago. |
| sango-transdona malario | pluraj plasmodioj | plasmodium trandonita per transdono de sango, kunuzado de injektiloj, aŭ nadlopika vundo |
| vivax malario, Plasmodium vivax malario | Plasmodium vivax |
Malebligo[redakti | redakti fonton]

Inter la rimedoj por malebligi malarion estas medikamentoj, moskito-forigo, kaj la malebligo de pikoj/mordoj. Ne estas vakcino kontraŭ malario. La ĉeesto de malario en regiono bezonas kombinaĵon de loĝantara denso, alta nombro da anofelesaj moskitoj, kaj ofta transdono de homoj al moskitoj kaj de moskitoj al homoj. Se iu ajn el tiuj sufiĉe malpli altiĝas, la parazito finfine malaperos de tiu regiono, kiel okazis en Norda Ameriko, Eŭropo, kaj partoj de la Meza Oriento (ekz. Brita Palestino, nuntempa Israelo). Tamen, se oni ne forigas la paraziton el la tuta mondo, ĝi povus reveni se kondiĉoj reiras al kombinaĵo, kiu helpas la multobliĝon de la parazito. Aldone, la po-homa kosto de forigo kreskas kun la malkresko de la loĝantara denso, kaj tio signifas, ke en kelkaj lokoj estas tro multekosta elimini la paraziton.[54]
Malebligo de malario eble estas laŭkoste pli efika, ol kuracado de la malsano el longtempa vidpunkto, sed la komencaj kostoj bezonataj estas nepageblaj por multaj el la plej malriĉaj homoj de la mondo. La kosto de forigaj kaj malebligaj programoj povas esti tre malsimila en unu lando, disde alia. Ekzemple, en Ĉinio, kies registaro en 2010 anoncis kampanjon por entute forigi malarion ĉe la Ĉinaj provincoj, la bezonata investo estis malgranda proporcio de la publika elspezo por sano. Kontraste, se oni kreus similan programon en Tanzanio, la koston oni taksus je kvinono de la publik-sana buĝeto.[55]
En lokoj, en kiuj malario estas ofta, infanoj, kiuj havas malpli ol kvin jaroj ofte suferas anemion, kiu foje estas pro malario. Doni kontraŭ-malariajn medikamentiojn al infanoj anemio-suferantaj, iomete plialtigas la kvanton da ruĝaj sango-ĉeloj en ilia sango, sed ne ŝanĝas la riskon de morto, aŭ la bezonon por enhospitaligo.[56]
Malhelpo de transdono per moskitoj[redakti | redakti fonton]

Unu rimedo por malpliigi la oftecon de malario estas malhelpi, ke moskitoj transdonu la parazitojn. Por protekti solajn homojn, la plej efikaj substancoj por forpeli insektojn baziĝas sur DEET (duetila-toluamido) aŭ ikaridino.[57] Kulvualoj (kontraŭ-moskitaj vualoj), kiuj surhavas insekticidon, montriĝis tre efikaj por malebligi malarion inter geknaboj en lokoj, kie malario oftas.[58][59] Senprokrasta kuracado de konfirmitaj kazoj per kombinaĵo da medikamentoj, kiuj enhavas Artesunaton, ankaŭ povas malhelpi la transdonon.[60]


Kulvualoj helpas teni moskitojn for de homoj kaj malpliigi la oftecon de infektiĝo kaj transdono de malario. Vualoj ne estas perfekta barilo, kaj ofte surhavas insekticidon, kiu mortigas la moskiton, antaŭ ol ĝi povas trovi vojon por trapasi la vualon. Oni taksas la efikon de vualoj, kiuj surhavas insekticidon, je dufoje pli ol la efiko de seninsekticidaj vualoj, kaj uzi vualon oferas pli ol 70% pli efika protekto, ol ne uzi vualon.[61] Inter 2000 kaj 2008, la uzo de insekticido-havajn vualojn savis la vivojn de proksimume 250 000 beboj en Sub-Sahara Afriko.[62] Proksimume 13% da domoj en Sub-Saharaj landoj havis insekticido-havajn vualojn en 2007[63] kaj oni taksis, ke 31% da afrikaj domoj havis almenaŭ po unu vualon en 2008. En 2010, 1.7 milionoj (1.8%) da Afrikaj infanoj, kiuj vivas en regionoj de la mondo, kie malaria estas ofta, estis protektitaj de vualoj portantaj insekticidon. Tiu cifero pligrandiĝis al 20.3 milionoj (18.5%) da afrikaj infanoj, kiuj uzis la insekticidajn vualojn en 2007; 89.6 milionoj da infanoj restis senprotektaj.[64] La nombro da uzantoj de insekticidaj vualoj atingis 68% da afrikaj infanoj.[65]
La plimulto el la vualoj surhavas piretrinon kaj parencajn substancojn, kiuj apartenas al grupo da insekticidoj kun malalta tokseco. Ili estas plej efikaj, kiam oni utiligas ilin inter vesperiĝo kaj mateniĝo.[66] Oni rekomendas, pendi grandan "lito-vualon" super la centro de lito, kaj aŭ foldi la randojn sub la matraco, aŭ certigi, ke ĝi estas sufiĉe granda, por tuŝi la teron.[67]
Endoma restaĵa ŝprucado estas la ŝprucado de insekticidoj sur la murojn ene de domo. Post manĝado, pluraj moskitoj ripozas sur apuda surfaco dum ili digestas la sango-manĝaĵon. Tial, se la muroj de domoj surhavas insekticidon, eblas mortigi la moskitojn dum ili ripozas, antaŭ ol ili povas piki alian homon kaj transdoni la malarian paraziton.[68] Je 2006, la Monda Organizaĵo pri Sano rekomendas 12 insekticidojn por ŝprucado sur la domo-muroj, inkluzive DDT kaj la piretroidoj ciflutrino kaj deltametrino.[69] Ĉi-tiun uzon de malgrandaj kvantoj de DDT por celoj de publika sano oni permesas laŭ la Stokholma Konvencio, kiu malpermesas ĝian agrikulturan uzadon.[70] Unu problemo kun en-doma ŝprucado de insekticidoj estas la rezisto-kapablo ĉe la moskitoj. Moskitoj, kontraŭ kiuj la en-doma insekticido plej efikas, emas ripozi kaj vivi en-dome, kaj pro la incito de la ŝprucado, iliaj idoj emas ripozi kaj vivi ekster-dome, kiu signifas, ke la en-doma insekticido malpli efikas kontraŭ ili.[71]
Estas pluraj aliaj rimedoj por malpliigi la oftecon de moskito-pikiĝo kaj malrapidigi la disvastiĝon de malario. Provoj malplimultigi moskito-larvojn per la malpliigo de la malferma akvo, en kiuj ili disvolviĝas, aŭ per la aldono de substancoj al la akvo por malpliigi ilian disvolviĝon, efikas en kelkaj lokoj.[72] Ne estas pruvoj pri la efiko de elektronikaj moskito-forigiloj, kiuj faras tre alt-frekvencajn sonojn, por forigi inajn moskitojn.[73]
Medikamentoj[redakti | redakti fonton]
Estas pluraj drogoj, kiuj povas helpi la malebligon aŭ ĉesigon de malario ĉe vojaĝantoj al lokoj, kie infektiĝo oftas. Multaj el ĉi tiuj drogoj ankaŭ uziĝas por kuracado. Oni povas uzi klorokinon en lokoj, kie la plimulto da parazitoj ne disvolvis kontraŭ-klorokinan-rezistopovon.[74] En lokoj, kie Plasmodio havas rezistokapablon kontraŭ unu aŭ pliaj medikamentoj, tri kombinaĵoj - meflokino (Lariam), doksiciklino (ĝenerale havebla), aŭ la kombinaĵo de atovakvono kaj progvanila hidroklorido (Malarone) - ofte uziĝas por malhelpi la infektiĝon.[74] Doksiciklino kaj atovakvono kun progvanilo estas la plej facile tolereblaj; meflokino ligiĝis kun morto, sinmortigo, kaj neŭrologiaj kaj psikiatraj simptomoj.[74]
La protekta efiko ne tuj komencas, kaj homoj, kiuj vizitas regionojn kie estas malario plej ofte komencas uzi la medikamenton je unu aŭ du semajnoj antaŭ ol la alveno, kaj daŭras uzi ilin dum kvar semajnoj post la reiro (escepte de atovakvono/progvanilo, kies uzo oni komencu nur du tagojn antaŭ, kaj daŭrigu dum sep tagoj poste).[75] La uzo de malebligaj drogoj ofte ne estas konvena por tiuj, kiuj vivas en regionoj kie estas malario, kaj ĝenerale la drogoj uziĝas nur ĉe gravedaj virinoj kaj mallongtempaj vizitantoj. Ĉi tiu estas pro la kosto de la medikamentoj, la kromefikoj de long-tempa zuo, kaj la malfacila disponebleco de kontraŭ-malariaj drogoj ekster la riĉaj landoj.[76] Montriĝis, ke kontraŭ-malariaj medikamentoj, uzataj de patrino dum gravedo, plibonigas la pezon de la bebo je naskiĝo, kaj malgradigas la riskon de anemio ĉe la patrino.[77] La uzo de kontraŭ-malariaj drogoj je la ĉeesto de malario-transdonantaj moskitoj, povas helpi la disvolvon de ioma rezistemo.[78]
Kuracado[redakti | redakti fonton]
Malarion oni kuracas per kontraŭmalariaj medikamentoj; la medikamento uzata dependas de la speco kaj severeco de la malsano. Dum kontraŭfebraj medikamentoj komune uziĝas, la efikoj de ilia utilo ne estas klare videblaj.[79]
Senkomplika malario povas kuraciĝi per engluteblaj medikamentoj. La plej efika kuracado por infektiĝo per P. falciparum estas la uzo de artemisininoj en kombinaĵo kun aliaj kontraŭmalariaj medikamentoj (konata kiel artemisinina kombinaĵo-terapio, aŭ AKT), kiu malpliigas la rezistemo al iu ajn unueca drog-ingredienco.[80] Ĉi tiuj aldonaj kontraŭmalariaj medikamentoj inkluzivas: amodiakinon, lumefantrinon, melfokinon, aŭ sulfadoksin/pirimetaminon.[81] Alia kombinaĵo estas duhidroartemisinino kaj piperakino.[82][83] AKT efikas je proksimume 90% kiam oni utilas ĝin por kuraci senkomplikan malarion.[62] Por kuraci malarion dum gravedeco, la Monda Organizaĵo pri Sano rekomendas la uzadon de kinino kune kun klindamicino frue en la gravedeco (dum la unuaj tri monatoj), kaj AKT dum postaj stadioj (2a kaj 3a trimestroj).[84] Dum la 2000-aj jaroj, malario kun parta rezistemo kontraŭ artemisinoj aperis en Sud-orienta Azio.[85][86]
Rekomendata kuracado por severa malario estas la injekta uzado de kontraŭmalariaj drogoj. Kontraŭ severa malario, artesunato estas pli bona ol kinino, kaj en infanoj kaj en plenkreskuloj.[87] Kuracado de severa malario inkluzivas subtenajn rimedojn, kiuj plej bone fariĝas ĉe flegejo pri severaj malsanoj ĉe malsanulejo. Ĉi tiu inkluzivas la prizorgadon de altaj febroj, kaj la konvulsiojn, kiuj povas sekvi de ĝi. Ĝi ankaŭ inkluzivas kontroladon por malfacila spirado, malaltan suker-nivelon ĉe la sango, kaj malaltan nivelon de kalio ĉe la sango.[24]
Rezistemo[redakti | redakti fonton]
Kontraŭ-droga rezistemo estas kreskanta problemo en la 21a-jarcenta kuracado de malario.[88] Rezistemo estas nun ofta kontraŭ ĉiuj specoj de kontraŭmalariaj drogoj krom artemisininoj. Kuracado de rezistemaj variantoj dependis pli kaj pli multe de tiu klaso da drogoj. La kosto de artemisininoj limigas ilian utilon en la disvolviĝanta mondo.[89] Malariaj variantoj trovataj ĉe la landlimo inter Kamboĝo kaj Tajlando montras rezistemon al kombinaĵaj terapioj, kiuj inkluzivas artemisininojn, kaj tial eble estas nekuraceblaj. [90] Aliro de la parazitoj al terapioj, kiuj enhavas sole artemisininojn, dum pli ol 30 jaroj, plej eble instigis al la elektiĝo de la rezistema fenotipo.[91] Oni trovis rezistemon kontraŭ artemisininoj en Kamboĝo, Birmo (Mjanmao), Tajlando, kaj Vjetnamio,[92] kaj rezistemo ankaŭ disvolviĝas en Laoso.[93][94]
Prognozo[redakti | redakti fonton]
Kiam oni ĝuste kuracas la malsanon, homoj kiuj suferas pro malario plej ofte povas atendi tutan resaniĝon.[95] Tamen, severa malario povas progresi tre rapide kaj kaŭzi morton post horoj aŭ tagoj.[96] En la plej severaj kazoj de la malsano, morto-procentoj povas atingi 20%, eĉ kun intensa kuracado kaj flegado.[12] Dum pli longa tempo, disvolviĝaj misfunkcioj montriĝis ĉe infanoj, kiuj suferis epizodojn de severa malario.[97] Long-daŭra infektiĝo sen severa malsano povas okazi ĉe imun-malsufiĉeca sindromo, kunligita kun malpliigita respondemo al Salmonella bakterio kaj la viruso Epstein-Barr.[98]
Dum infaneco, malario kaŭzas anemion dum tempo de rapida cerba disvolviĝo, kaj ankaŭ rekta cerbo-damaĝo pro cerebra malario.[97] Kelkaj travivintoj de cerba malario havas pli grandan riskon de neŭrologiaj kaj kogna malsufiĉoj, kondutaj nenormalecoj, kaj epilepsio. [99] Montriĝis, ke kontraŭ-malariaj kuraciloj plibonigas kognan funkciadon kaj lernejaj rezultoj en esploroj, kompare kun grupoj, kiuj ricevis ŝajnkuracilon.[97]
Epidemiologio[redakti | redakti fonton]
La Monda Organizaĵo pri Sano taksas, ke en 2010 estis 219 milionoj da kazoj de malario, kiuj rezultis en 660 000 mortoj.[12][100] Aliaj taksis, ke la nombro da kazoj de falciparum-a malario estas inter 350 kaj 550 milionoj,[101] kaj mortoj en 2010 je 1.24 milionoj[102], pli multe ol la 1.0 miliono da mortoj en 1990.[103] La plimulto da kazoj (65%) okazas en infanoj, malpli ol 15-jaraĝaj.[102] Proksimume 125 milionoj da gravedaj virinoj riskas infektiĝon ĉiujare; en Sub-Sahara Afriko, malario ĉe patrinoj ligiĝis kun mortoj de ĝis 200 000 mortoj de novnaskitoj jare.[20] Estas proksimume 10 000 kazoj jare en Okcidenta Eŭropo, kaj 1300-1500 en Usono.[16] Proksimume 900 homoj mortis pro la malsano en Eŭropo inter 1993 kaj 2003.[57] Kaj la tutmonda ofteco de la malsano kaj la rezulta morto-ciferoj malpliiĝis dum lastaj jaroj. Laŭ la WHO (Monda Organizaĵo pri Sano) kaj UNICEF, mortoj atribueblaj al malario en 2016 malpliiĝis je 60%[65] de takso en 2000 de 985 000, plejparte pro vasta utilo de vualoj, kiuj surhavis insekticidon, kaj kombinaĵo-terapioj, kiuj inkluzivas artemisininojn.[62] En 2012, estis 207 milionoj da kazoj de malario. Dum tiu jaro, oni taksas, ke la malsano mortigis inter 473 000 kaj 789 000 homojn, multaj el kiuj estis infanoj en Afriko.[2] Klopodoj por malpliigi la malsanon en Afriko post la jarmilo-ŝanĝo estis parte efikaj, kun ofteco de la malsano malkreskiĝanta je proksimume 40 procento ĉe la kontinento.[104]
Malario estas ofta en vasta regiono ĉirkaŭ la ekvatoro, en regionoj de Ameriko, pluraj partoj de Azio, kaj multo da Afriko; en Sub-Sahara Afriko okazas 85-90% de mortoj pro malario.[105] Takso por 2009 raportis, ke landoj kun la plej altaj procentmilo da mortoj estis Ebur-Bordo (86.15), Angolo (56.93), kaj Burkina Faso (50.66)[106] Takso de 2010 montris, ke la landoj, kiuj spertis la plej multajn mortojn laŭ nombro da loĝantoj, estis Burkina Faso, Mozambiko, kaj Malio. [102] La Malario Atlas-Projekto celas fari mapon de monda ofteco de malario, donante rimedon per kiu oni povas trovi la mondajn spacajn limojn de la malsano kaj taksi ĝiajn ekonomiajn kaj aliajn kostojn.[107][108] Ĉi tiu klopodo kondukis al la eldono de mapo de ofteco de P. falciparum en 2010.[109] Je 2010, proksimume 100 landoj spertas oftan malarion.[100][110] Ĉiujare, 125 milionoj da internaciaj vojaĝantoj vizitas ci tiujn landojn, kaj pli ol 30 000 malsaniĝas pro la malsano. [57]
La geografia distribuiĝo de malario ene de grandaj regionoj estas malsimpla, kaj kun- kaj sen-malariaj regionoj ofte troviĝas en proksimeco.[111] Malario estas ofta en tropikaj kaj subtropikaj regionoj pro pluvo, oftaj altaj temperaturoj kaj alta humideco, kune kun senmovaj akvoj, en kiuj moskito-larvoj facile maturiĝas, kio donas al ili la medion, kiun ili bezonas por seninterompa reproduktiĝo.[112] En pli sekaj regionoj, oni povas pli-malpli ĝuste antaŭdiri la malariajn amasinfektiĝojn per mapado de pluvokvantoj.[113] Malario estas pli ofta ĉe kamparaj regionoj, ol ĉe urboj. Ekzemple, pluraj urboj en la Subregiono Granda Mekongo de Sudorienta Azio estas esence senmalariaj, sed la malsano estas ofta ĉe multaj kamparaj regionoj, inkluzive laŭ internaciaj landlimoj kaj arbarorandoj.[114] Kontraste, malario en Afriko ĉeestas en kaj kamparanaj kaj urbaj regionoj, kvankam la risko estas malpli alta en la pli grandaj urboj.[115]
Historio[redakti | redakti fonton]

Kvankam la parazito, kiu kaŭzas la malarion, nome P. falciparum, ekzistis dum inter 50 kaj 100 jarmiloj, la grando de la nombro da la parazitaro ne pligrandiĝis ĝis proksimume antaŭ 10 jarmiloj, samtempe kun la disvolviĝo de la agrikulturo[116] kaj la disvolviĝo de homa setlado. Proksimaj parencoj de homaj malariaj parazitoj restas oftaj ĉe ĉimpanzoj. Iuj signoj sugestas, ke la malario P. falciparum originis ĉe goriloj.[117]
Referencoj al la unikaj reokazantaj febroj de malario troviĝas tra la tuta registrita historio.[118] Hipokrato priskribis regule reokazantajn febrojn, kaj nomis ilin triajn, kvarajn, subtriajn, kaj ĉiutagajn.[119] La Romia Kolumelo notis la konekton inter la malsano kaj insektoj de marĉoj.[119] Malario eble kontribuis al la malkresko de la Roma Imperio,[120] kaj estis tiom ofta ĉe Romo, ke ĝi konatiĝis kiel la "Roma febro".[121] Pluraj regionoj en antikva Romo konsideriĝis precipe alt-riskaj pro la ĉeestantaj favoraj kondiĉoj por malariaj transdonantoj. Ĉi tiu inkluzivis regionojn, kiel suda Italio, la insulo de Sardio, la Pontinaj Marĉoj, la malpli altaj regionoj de marborda Etrurio kaj la urbo de Romo laŭ la Tiber-Rivero. Moskitoj preferis ĉi tiajn lokojn por bredejoj pro la ĉeesto de senmova akvo. Irigaciitaj ĝardenoj, marĉosimilaj teroj, elfluo de agrikulturaj kampoj, kaj problemoj pri forfluo de akvo pro vojo-konstruo, kondukis al la pliofteco de senmova akvo.[122]

La vorto malario devenas de la mezepoka Itala "mala aria" (malbona aero); oni nomis la malsanon "marĉofebro" pro ĝia ligo al marĉoj kaj marĉaj ejoj.[123] Malario iam estis ofta en la plejparto de Eŭropo kaj Norda Ameriko,[124] kie ĝi ne plu oftas,[125] kvankam importitaj kazoj foje aperas.[126]
Sciencaj esploroj pri malario unue notinde progresis en 1880, kiam Charles Louis Alphonse Laveran — nome franca armea kuracisto, kiu laboris ĉe milita malsanulejo de Konstantino (Alĝerio) - unuafoje notis parazitojn interne de la ruĝaj sangoĉeloj de infektitaj homoj. Li tial proponis, ke malarion kaŭzas ĉi tiu organismo, kiam oni notis, ke protisto kaŭzis malsanon.[127] Pro ĉi tiu kaj postaj malkovroj, oni donis al li la Nobel-premion pri fiziologio aŭ medicino en 1907. Unu jaron poste, Carlos Finlay, Kuba kuracisto, kiu pritraktis homojn kun flava febro en Havano, donis fortajn pruvojn, ke moskitoj trandonis la malsonon al kaj el homoj.[128] Ĉi tiu laboro sekvis pli fruajn sugestojn de Josiah C. Nott,[129] kaj laboro de Sir Patrick Manson, la "patro de tropika medicino", pri la transdono de filariazo.[130]

En Aprilo 1894, skota kuracisto Sir Ronald Ross vizitis Sir Patrick Manson-on ĉe lia domo ĉe Queen Anne Strato, Londono. Ilia vizito estis la komenco de kvar jaroj da kunlaborado kaj fervora esplorado, kiu kulminis en 1898 kiam Ross, kiu laboris ĉe la Presidency Ĝenerala Hospitalo en Kolkato, montris la tutan vivo-ciklon de la malaria parazito en moskitoj. Li tiel pruvis, ke la moskito estis la transdonanto por malario en homoj per pruvo, ke certaj moskito-specoj transdonas malarion al birdoj. Li izolis malari-parazitojn de la salivo-glandoj de moskitoj, kiuj manĝis ĉe infektitaj birdoj.[131] Pro ĉi tiu laboro, Ross ricevis la Nobel-Premion pri Medicino en 1902. Post kiam li eksiĝis de la Hinduja Medicina Servo, Ross laboris ĉe la nove fondita Liverpool Lernejo de Tropika Medicino, kaj estris malari-regajn klopodojn en Egiptio, Panamo, Grekio kaj Maŭricio.[132] La eltrovoj de Finlay kaj Ross poste konfirmiĝis de medicina spertularo estrita de Walter Reed en 1900. Ĝiaj rekomendoj estis efektivigitaj de William C. Gorgas en la rimedoj, per kiu oni malebligis la malsanon dum la konstruado de la Panama kanalo. Ĉi-tiu laboro pri publika sano savis la vivojn de miloj da laboristoj, kaj helpis pri la disvolviĝo de la rimedoj, kiujn oni utilis en postaj kampanjoj pri publika sano kontraŭ la malsano.[133]

La unua efika kuracado kontraŭ malario devenis de la ŝelo de la Kinkono, kiu enhavas kininon. Ĉi tiu arbo kreskas ĉe la deklivoj de la Andoj, ĉefe en Peruo. La indiĝenaj popoloj de Peruo faris tinkturon de kinkono por malpliigi febron. Oni trovis ĝin efika kontraŭ malario, kaj la Jesuitoj enkondukis la rimedon al Eŭropo ĉirkaŭ 1640; antaŭ ol 1677, ĝi inkluziviĝis en la Londona Farmakopeo kiel kontraŭmalaria kuracilo.[134] Nur en 1820 oni elĉerpis la aktivan ingrediencon de la arboŝelo, izolis kaj nomiĝis ĝin fare de la Francaj kemiistoj Pierre Joseph Pelletier kaj Joseph Bienaimé Caventou.[135][136]
Kinino fariĝis la ĉefa kontraŭmalaria medikamento ĝis la 1920-aj jaroj, kiam aliaj medikamentoj ekdisvolviĝis. Dum la 1940-aj jaroj, klorokino anstataŭis kininon kiel la kuracilo de kaj senkomplika kaj severa malarioj ĝis kiam rezistemeco ŝanĝis la situacion, unue en Sudorienta Azio kaj Suda Ameriko en la 1950-aj jaroj kaj tutmonde dum la 1980-aj jaroj.[137]
La medicina valoro de Artemisia annua estis uzata de ĉinaj herbokuracistoj en tradiciaj ĉinaj medikamentoj dum du mil jaroj. En 1596, Li Shizhen rekomendis teon faritan de qinghao (artemisinino), precize por kuraci malariajn simptomojn, en sia "Kompendio de Materialoj Medikamentaj". Artemisininoj, eltrovitaj de ĉina sciencisto Tu Youyou kaj kolegoj en la 1970-aj jaroj de la planto Artemisia annua, fariĝis la rekomendita kuracado por malario P. falciparum, uzita en kombinaĵo kun aliaj kontraŭmalariaĵoj kontraŭ severa malsano.[138] Tu diras, ke ŝi influiĝis de Ĉina tradicia herba medicina fonto, nome La Manlibro de Preskriboj por Grave Bezonataj Kuracadoj, verkita en 340 de Ge Hong[139] Pro sia laboro pri malario, Tu Youyou ricevis la Nobel-premion pri fiziologio aŭ medicino en 2015[140]
Plasmodium vivax uziĝis inter 1917 kaj la 1940-aj jaroj por "malarioterapio" - intenca injektado de malariaj parazitoj por kaŭzi febron por kontraŭbatali kelkajn malsanojn, kiel triaranga sifiliso. La inventinto de ĉi tiu tekniko, Julius Wagner-Jauregg, ricevis la Nobel-Premion pri medicino de 1927 pro siaj malkovroj. La tekniko estis danĝera, kaj mortigis proksimume 15%-on el la pacientoj. Tial ĝi ne plu uziĝas.[141]

La unua pesticido, kiu uziĝis por endoma restaĵa ŝprucado, estis DDT.[142] Kvankam ĝi unue uziĝis nur por kontraŭbatali malarion, ĝia uzado rapide plivastiĝis al agrikulturo. Post iome, regado de damaĝantaj insektoj, anstataŭ ol malpliigo de malsano, iĝis la ĉefa uzo de DDT, kaj ĉi tiu grand-skala agrikultura uzado kondukis al la evoluiĝo de kontraŭpesticide rezistemaj moskitoj en multaj lokoj. La kontraŭ-DDT-a rezistemeco, kiun montras Anofelesaj moskitoj kompareblas kun antibiotika rezistemeco ĉe bakterioj. Dum la 1960-aj jaroj, konsciiĝo pri la malbonaj sekvoj de ĝia sendistinga uzo pliiĝis, kiu finfine kondukis al vastaj malpermesoj de agrikulturaj uzoj de DDT en multaj landoj dum la 1970-aj jaroj.[70] Antaŭ DDT, malario sukcese aŭ eliminiĝis aŭ regiĝis en tropikaj regionoj kiel Brazilo kaj Egiptio per la forigo aŭ venenigo de la bredejoj de la moskitoj aŭ la akvaj loĝlokoj de la larvaj stadioj, ekzemple per la apliko de la tre venena arsena kombinaĵo Paris green (Pariza verdo) al lokoj kun senmova akvo.[143]
Kontraŭ-malariaj vakcinoj montriĝis malfacile troveblaj. La unuaj studoj, kiuj montris la kapablon por kontraŭ-malaria vakcino fariĝis en 1967 per la imunigo de musoj per vivaj sporozoitoj, kiuj estis malfortigitaj per radiado. La malfortigitaj sporozoitoj notinde protektis la musojn je posta injektado per normalaj, vivaj sporozoitoj. Ek de la 1970-aj jaroj, estis konsiderindaj klopodoj elvolvi similajn vakcinajn rimedojn por homoj.[144]
Socio kaj kulturo[redakti | redakti fonton]
Ekonomiaj efikoj[redakti | redakti fonton]

Malario ne nur ofte ligiĝas kun malriĉeco. Kelkaj signoj sugestas, ke ĝi estas unu el la kaŭzoj de malriĉeco, kaj grava malhelpo al ekonomia disvolviĝo.[8][9] Kvankam tropikaj regionoj plej influiĝis, la plej vasta influo de malario atingas kelkajn moder-temperaturajn zonojn, kie estas ekstremaj sezonaj ŝanĝiĝoj. La malsano ligiĝis kun gravaj negativaj ekonomiaj efikoj ĉe regionoj, kie ĝi estas vaste trovata. Dum la malfrua 19a kaj frua 20a jarcentoj, ĝi estis grava faktoro en la malrapida ekonomia disvolviĝo de la usonaj sudaj ŝtatoj.[145]
Komparo de meznivela Malneta Enlanda Produkto po kapo en 1995, ĝustigita laŭ egaleco de aĉeto-kapablo, inter landoj kun malario kaj landoj sen malario montras kvinoblan malsamon (1,526 usonaj dolaroj kontraŭ 8,268 usonaj dolaroj). Dum la periodo de 1965 ĝis 1990, landoj, kie malario estis ofta, havis mezan malnetan enlandan produkton po kapo kiu pligrandiĝis nur 0.4% jare, kompare kun 2.4% jare ĉe aliaj landoj.[146]
Malriĉeco povas pligrandigi la riskon de malario, ĉar al malriĉuloj mankas la financaj kapabloj malebligi aŭ kuraci la malsanon. En ĝia tuto, la ekonomia influo de malario laŭtakse kostis en Afriko 12 bilionojn de usonaj dolaroj ĉiujare. La ekonomia influo inkluzivas kostojn de kuracado, labortagojn perditajn pro malsano, tagojn perditajn de edukado, malpliigitan produktemecon pro cerbo-damaĝo pro cerebra malario, kaj perdo de investitaĵoj kaj turismo.[10] La malsano faras pezan ŝarĝon en kelkaj landoj, kie ĝi kaŭzas eble inter 30 kaj 50% da malsanulejaj enregistriĝoj, ĝis 50% da eksterhospitalaj vizitoj, kaj ĝis 40% da publik-sanaj elspezoj.[147]

Cerebra malario estas unu el la ĉefaj kaŭzoj de neŭrologiaj malkapabloj ĉe afrikaj infanoj.[99] Esploroj, kiuj komparas mensan funkciadon antaŭ kaj post kuracado pro severa malaria malsano, daŭre montris notinde malhelpitan funkciadon ĉe lernejaj taskoj kaj ĉe mensaj kapabloj, eĉ post resaniĝo.[97] Sekve, severa kaj cerebra malario havas gravajn soci-ekonomiajn sekvojn, kiuj etendiĝas pli vaste ol la baldaŭaj efikoj de la malsano.[148]
Falsitaj kaj subnormaj drogoj[redakti | redakti fonton]
Lerte faritaj falsitaj drogoj troviĝis en pluraj aziaj landoj kiel Kamboĝo,[149] Ĉinio,[150] Indonezio, Laoso, Tajlando, kaj Vjetnamio, kaj estas grava kaŭzo de evitebla mortaro en tiuj landoj.[151] La Monda Organizaĵo pri Sano diris, ke studoj sugestas, ke ĝis 40% de medikamentoj artesunato-bazitaj estas falsaj, precipe en la Subregiono Granda Mekongo, kaj fondis rapid-vigligan sistemon por ebligi, ke informoj pri falsaj drogoj rapide raportiĝis al la koncernaj aŭtoritatoj en la partoprenantaj landoj.[152] Estas neniu fidinda rimedo, per kiu kuracisto aŭ nekuracisto povas detekti falsajn drogojn sen helpo de laboratorio. Kompanio klopodas kontraŭi la persistemon de falsaj drogoj per la uzado de nova teknologio por doni sekurecon de fonto ĝis distribuiĝo.[153]
Alia klinika kaj publik-sana koncerno estas la plivastiĝo de subnormaj kontraŭmalariaj medikamentoj, kiu rezultas de netaŭga koncentriĝo de ingrediencoj, la enmiksiĝo de aliaj drogoj aŭ toksaj malpuraĵoj, malalt-kvalitaj ingrediencoj, nesufiĉa stabileco kaj netaŭga pakaĵo.[154] Esploro de 2012 montris, ke ĉirkaŭ unu triono de kontraŭmalariaj medikamentoj en Sud-orienta Azio kaj Sub-Sahara Afriko aŭ malsukcesis je kemia analizo, aŭ pakaĵa analizo, aŭ estis falsigitaj.[155]
Milito[redakti | redakti fonton]

Tra la tuta historio, la infektiĝo per malario ludis gravan rolon en la fatoj de registaraj regantoj, naci-ŝtatoj, militaj personaroj, kaj militaj agadoj.[156] En 1910, Ronald Ross, gajninto de la Nobel-premio pri medicino, kiu mem travivis malarion, publikigis libron kun la titolo La Malebligo de Malario, kiu enhavis ĉapitron kun la titolo, "La Malebligo de Malario dum Milito." La aŭtoro de la ĉapitro, Kolonelo C. H. Melville, Profesoro pri Higieno ĉe Royal Army Medical College (Reĝa Armea Medicina Kolegio) en Londono, pritraktis la elstaran rolon, kiun malario historie ludis dum militoj: "La historio de malario dum milito preskaŭ povus kompreniĝi kiel la historio de milito mem, certe la historio de milito dum la Kristana erao. ... Probable veras, ke multaj el la tiel-nomataj tendaraj febroj, kaj probable ankaŭ konsiderinda proporcio el tendara disenterio, dum la militoj de la dek sesa, dek sepa, kaj dek oka jarcentoj estis malariaj origine."[157]
En 1895, la ekspedicio franca al Madagaskaro estis "sano-katastrofo": el 21 600 viroj, kiuj elŝipiĝis, 5 731 mortis pro malario, kaj 25 mortis batale.[158] Notindas ke ĉi tiu speco de "katastrofo" reproduktiĝis poste, ĉe la nord-vjetnamaj soldatoj dum la Vjetnama milito.
Malario estis la plej grava danĝero al sano, kiun renkontis la usona armeo en la Suda Pacifiko dum la Dua Mondmilito, kie proksimume 500 000 viroj infektiĝis.[159] Laŭ Joseph Patrick Byrne, "Sesdek mil usonaj soldatoj mortis pro malario dum la afrikaj kaj sud-pacifikaj kampanjoj."[160]
Elstarajn financajn elspezojn oni faris por akiri ekzistantajn kaj krei novajn kontraŭ-malariajn kuracilojn. Dum la Unua mondmilito kaj la Dua mondmilito, malstabilaj stokoj de la naturaj kontraŭ-malariaj drogoj kinkona arboŝelo kaj kinino instigis notindan elspezon por esploro kaj disvolviĝo de aliaj drogoj kaj vakcinoj.
Klopodoj por elradikigo[redakti | redakti fonton]

Plurajn notindajn klopodojn oni faras por elradikiĝi la paraziton de partoj de la mondo, aŭ elradikiĝi ĝin tutmonde. En 2006, la organizo Malaria No More (Malario Ne Plu) starigis kiel publika celo la elradikiĝon de malario de Afriko antaŭ la fino de 2015, kaj la organizo planis malfondiĝi se la celo atingiĝas.[161] Pluraj malariaj vakcinoj troviĝas en klinikaj provoj, per kiuj oni volas doni protekton al infanoj en endemiaj lokoj kaj malpliigi la rapidon de transdono de la malsano. Ĝis 2012, la Global Fund to Fight AIDS, Tuberculosis and Malaria (Monda Fonduso por Kontraŭbatali Aidoson, Tuberkulozon kaj Malarion) distribuis 230 milionojn da insekticido-surhavantaj vualoj, per kiuj oni volas haltigi trasdonon de malario pere de moskitoj.[162] La Fondaĵo Clinton, bazita en Usono, laboris por regi la mendadon kaj stabiligi prezojn en la artemisinino-merkato.[163] Aliaj klopodoj, kiel la Malaria Atlas Project (Malaria Atlaso-Projekto), koncentriĝas en la analizo de klimataj kaj veteraj informoj bezonataj por ĝuste antaŭdiri la disvastiĝon de malario surbaze de la disponebleco de loĝlokoj por la malari-portantaj parazitoj.[107] La Malaria Policy Advisory Committee (Malaria Politik-Konsila Komitato, MPAC) de la Monda Organizaĵo pri Sano (WHO) fondiĝis en 2012, "por disponebligi strategiajn konsilojn kaj teknikajn rimedojn al WHO pri ĉiuj aspektoj de malaria kontrolo kaj elradikiĝo".[164] En Novembro 2013, WHO kaj la grupo de subvenciantoj de malaria-vakcinaj esploroj kreis celon por disvolvigi vakcinojn, per kiujn oni planas interrompi la transdonon de malario kun la fina celo de elradikiĝo de malario.[165]
Malarion oni sukcese eliminigis aŭ multe malpliigis en certaj regionoj. Malario estis iam ofta en Usono kaj suda Eŭropo, sed programoj por kontroli transdonantojn, kune kun la kontrolado kaj kuracado de infektitaj homoj, eliminis ĝin de tiuj regionoj. Pluraj faktoroj kontribuis, kiel la forfluigo de marĉaj bredejoj por agrikulturo kaj aliaj ŝanĝoj en la rego-praktikoj pri akvo, progresoj en higienaj praktikoj, kiuj inkluzivas pli oftan uzon de vitraj fenestroj kaj fenestraj dratretoj en loĝejoj.[166] Malario eliminiĝis de la plimulto de Usono dum la frua 20a jarcento per tiaj rimedoj, kaj la uzo de la pesticidoj DDT kaj aliaj rimedoj eliminis ĝin el la restantaj malgrandaj regionoj de la Sudo dum la 1950-aj jaroj. [167] En Surinamo, la malsano eliminiĝis el la ĉefurbo kaj marbordaj regionoj per tri-flanka kampanjo iniciata de la Global Malaria Eradication Program (Tutmonda Malario-Elradika Programo) en 1955, kiu inkluzivis: kontrolon de transdono per uzo de DDT kaj IRS (Interna Restaĵa Sprucado de insekticido); regulan kolektiĝon de sango-specimenoj de la loĝantaro por trovi ekzistantajn malario-kazojn; kaj la provizon de kemiterapio al ĉiuj infektitoj.[168] Butano sekvas fortan malari-elradikigan strategion, kaj atingis 98.7%-an malpliigon en mikroskope-konfirmitaj kazoj de 1994 ĝis 2010. Kune kun transdonanto-kontrolaj rimedoj kiel IRS en lokoj de alta risko, kaj disdono de long-daŭraj ITN-oj (Kontraŭ-moskitaj vualoj, kiuj surhavas insekticidon), faktoroj kiel ekonomia disvolviĝo kaj pliigita aliro al sano-servoj kontribuis al la sukcesoj de Butano rilate al la malpliigo de la ofteco de malario.[169] La Departamento pri Internacia Disvolviĝo (Department for International Development) de la Unuiĝinta Reĝlando kaj la Fondaĵo Bill kaj Melinda Gates elspezis 4.5 mil milionojn de usonaj dolaroj dum kvin jaroj ek de 2016 klopodante ĉesigi mortojn kaŭzitajn de la malsano.[170]
En februaro 2021 Salvadoro fariĝis la unua lando en Centra Ameriko kiun oni konsideras «libera de malario».
La Tutmonda Fonduso por Batali Kontraŭ Aidoso, Tuberkulozo kaj Malario (angle The Global Fund to Fight AIDS, Tuberculosis and Malaria, ofte nomita The Global Fund (La Tutmonda Fonduso)) estas internacia financa institucio establita en januaro 2002 por draste pliigi financadon por la batalo kontraŭ la tri epidemiaj malsanoj de aidoso, tuberkulozo kaj malario. Ĝis nun, pli ol 2,7 miliardoj da dolaroj estis investitaj en pli ol 150 landoj tra la mondo por batali kontraŭ kaj ekstermi ĉi tiujn malsanojn [171][172].
Esploro[redakti | redakti fonton]
La Malaria Eradication Research Agenda (Malaria Elradikigo Esploro-Tagordo, mal-ERA) estis konsulta procezo por identigi tiujn kampojn por esploro kaj disvolviĝo, kiujn oni devis pritrakti por la tutmonda elradikigo de malario.[173][174]
Vakcino[redakti | redakti fonton]
Imuneco (aŭ, pli ĝuste, toleremo) al P. falciparum malario okazas nature, sed nur reage al multaj jaroj da infektiĝado.[37] Unuopuloj povas protektiĝi de infektiĝo P. falciparum se ili ricevas proksimume mil pikojn de moskitoj, kiuj portas version de la parazito, senigitan de la infektokapablo per surradiado per X-radioj.[175] Efika vakcino ĝis nun ne disponeblas kontraŭ malario, kvankam oni disvolvas plurajn.[176] La plurmorfa eco de pluraj P. falciparum proteinoj kreas gravajn defiojn por vakcina dezajno. Vakcin-kandidatoj, kiuj celas antigenojn ĉe gametoj, zigotoj, aŭ ookinetoj en la moskita intestomezo celas malebligi la transdonon de malario. Ĉi tiuj transdono-malebligantaj vakcinoj enmetas antikorpojn en la homan sangon; kiam moskito manĝas sango-manĝon el protektata homo, ĉi tiuj antikorpoj malebligas, ke la parazito finu sian disvolviĝon interne de la moskito.[177] Aliaj vakcin-kandidatoj, celantaj la sango-stadion de la vivociklo de la parazito, estis malsufiĉaj sen alia helpo.[178] Ekzemple, SPf66 multe ekzameniĝis en lokoj, kie la malsano oftas en la 1990aj jaroj, sed provoj montris, ke ĝi estis nesufiĉe efika.[179] Plurajn eblajn vakcinojn, celantajn la antaŭ-eritrocita stadio de la vivo-ciklo de la parazito, oni disvolvas, kaj RTS estas ĉefa kandidato;[175] oni atendas la permeson produkti ĝin en 2015.[98] Usona bioteknologia kompanio, Sanaria, disvolvas antaŭ-eritrocitan malfortigitan vakcinon nomatan PfSPZ, kiu utilas kompletajn sporozoitojn por instigi imun-sisteman respondon.[180] En 2006, la Malaria Vakcina Konsila Komitato al la Monda Organizaĵo pri Sano skizis "Malarian Vakcin-Teknologian Vojmapon" kiu havas kiel stadia gvidosigno la "disvolviĝon kaj permesigon de unua-generacia malaria vakcino, kiu havas protektan efikecon de pli ol 50% kontraŭ severa malsano kaj morto, kaj daŭras pli ol unu jaron".[181]
Medikamentoj[redakti | redakti fonton]
Malariaj parazitoj enhavas apikoplastojn, organetoj ĝenerale trovataj en pantoj, kune kun ilia propraj genaroj. Oni opinias, ke ĉi tiuj apikoplastoj originis per la endosimbiozo de algoj, kaj ludas esencan rolon en pluraj aspektoj de parazita metabolo, kiel la biosintezo de grasaj acidoj. Pli ol 400 proteinoj troviĝis, kiuj estas produktataj de apikoplastoj, kaj oni nun esploras ĉi tiujn kiel eblajn celojn por novaj kontraŭ-malariaj drogoj.[182]
Kun la ekesto de drog-rezistemaj Plasmodium parazitoj, novaj strategioj disvolviĝis por kontraŭbatali la disvastiĝintan malsanon. Unu tia rimedo estas la enmeto de sinteza pirodoksa-amino-acidaj aduktoj, kiu enpreniĝis de la parazito kaj finfine malhelpas ĝian kapablon krei plurajn necesajn B-vitaminojn.[183][184] Kontraŭmalariaj drogoj, kiuj uzas sintezan metal-bazitan kunordigajn kompleksojn, nun altiras esploran atenton.[185][186]
- (+)-SJ733: Parto da pli vasta klaso da eksperimentaj drogoj nomataj spiroindolonoj. Ĝi malaktivigas la ATP4-proteinon de infektitaj ruĝaj sango-ĉeloj, kiuj ŝrumpigas kaj rigidigas la ĉelojn, simile al maljunaĝaj ĉeloj. Ĉi tiu instigas la imunan sistemon al la forigo de la infektitaj ĉeloj el la sistemo, kiel montrita ĉe muso-modelo. Je 2014, la Howard Hughes Medical Institute (Howard Hughes Medicina Instituto) planas Klinikan Provon Stadion Unu por taksi la sekurecon ĉe homoj[187]
- Ankaŭ NITD246 kaj NITD609 apartenas al la spiroindolona klaso, kaj celas la ATP4-proteinon.[187]
Aliaj[redakti | redakti fonton]
Ne-ĥemia transdono-kontrola strategio temas pri gena manipulado de malariaj moskitoj. Progresoj en genetikaj inĝenieradaj teknikoj ebligas la enmeton de fremda DNA en la moskitan genaron, kaj aŭ malpliigi la vivodaŭron de la moskito, aŭ fari ĝin pli rezistema al la malaria parazito.
Steril-insekta tekniko estas genetika rego-metodo, per kiu grandaj nombroj da nereproduktokapablaj viraj moskitoj koviĝas kaj ellasiĝas. Seksumado kun sovaĝaj inaj moskitoj malpliigas la nombron da sovaĝaj moskitoj ĉe la sekva generacio; adaj ellasoj finfine eliminas la celatan mosiktaron.[61]
Gena vicrivelado ludas ĉefan rolon en primalariaj esploroj. Post la rivelado de la plena sekvenco de kaj P. falciparum, kaj de unu el ĝiaj transdonantoj Anopheles gambiae, kaj de la homa genaro, la genetiko de ĉiuj tri organismoj en la malaria vivociklo povas studiĝi.[188] Alia nova uzo de genetika teknologio estas la kapablo produkti genetike modifitajn moskitojn, kiuj ne transdonas malarion, kiu povas permesi la biologan regadon de malaria transdono.[189]
En unu esploro, oni kreis genetike modifitan subspecion de Anopheles stephensi, kiu ne plu subtenis malarian transdonon, kaj ĉi tiu rezistemo transdoniĝis al la moskitaj idoj.[190]
Gena ŝanĝigo (angle, "Gene drive") estas tekniko por ŝanĝi sovaĝajn organismarojn, ekzemple por kontraŭbatali insektojn tiel, ke ili ne povas transdoni malsanojn (en certaj moskitoj en la kazoj de malario kaj Zika.[191]
Aliaj bestoj[redakti | redakti fonton]
Preskaŭ 200 parazitaj Plasmodium specioj identiĝis, kiuj infektas birdojn, reptiliojn, kaj mambestojn,[192] kaj ĉirkaŭ 30 specioj laŭnature infektas nehomajn primatojn.[193] Kelkaj malariaj parazitoj, kiuj efikas ĉe nehomaj primatoj (NHP) servas kiel modelaj organizoj por homaj malariaj parazitoj, kiel P. coatneyi (modelo por P. falciparum) kaj P. cynomolgi (P. vivax). Diagnozaj rimedoj, uzataj por detekti parazitojn ĉe nehomaj primatoj estas similaj al tiuj, kiuj utiliĝas ĉe homoj.[194] Malariaj parazitoj, kiuj infektas ronĝulojn vaste uziĝas por esploroj, kiel P. berghei.[195] Birda malario ĉefe efikas ĉe Paseroformaj birdoj, kaj grave minacas birdojn de Havajo, la Galapagoj, kaj aliaj insularoj. Oni scias, ke la parazito P. relictum ludas rolon en la limigo de la disvastiĝo kaj abundo de indiĝenaj Havajaj birdoj. Oni atendas, ke tutmonda varmiĝo pliigos la oftecon kaj disvastiĝon de birda malario, kiam pli altaj temperaturoj donos plej favorajn kondiĉojn por parazita reproduktiĝo.[196]
Bildoj[redakti | redakti fonton]
-
Eritrocito infektita de P. vivax
-
Bildo per elektrona mikroskopo, artefarite kolorigita, montras sporozoiton kiu migras tra la citoplasmo de enterocitoj de "Anopheles"
-
La landoj, kie oni scias, ke ekzistas malario, estas montritaj en ruĝa koloro. Fonto: Centro por Malsankontrolado kaj Preventado (Usono).
-
Distribuado de malario en la tuta mondo.
Referencoj[redakti | redakti fonton]
- ↑ Greenwood, Brian M.; Kalifa Bojang; Christopher J. M. Whitty; Geoffrey A. T. Targett (2005). “Malaria”, The Lancet 365 (9469), p. 1487–1498. doi:10.1016/s0140-6736(05)66420-3.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 Malaria Fact sheet N°94 (marto 2014). Alirita 28-a de aŭgusto 2014.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 Caraballo H (2014). “Emergency department management of mosquito-borne illness: Malaria, dengue, and west nile virus (angle: "urĝa medicina trakto de moskito-transdonitaj malsanoj: malario, dengo kaj okcidentnila viruso")”, Emergency Medicine Practice 16 (5).
- ↑ WHO. (2014) World Malaria Report 2014. Ĝenevo: Monda Organizaĵo pri Sano, p. 32–42. ISBN 978-92-4156483-0.
- ↑ 5,0 5,1 Organization, World Health. (2010) Guidelines for the treatment of malaria ("gvidlinioj pri la medicina trakto de malario"), 2‑a eldono, Ĝenevo: Monda Organizaĵo pri Sano, p. ix. ISBN 9789241547925.
- ↑ 6,0 6,1 6,2 Malaria Fact sheet N°94. WHO. Alirita 2a de Februaro 2016.
- ↑ WHO. (2014) World Malaria Report 2014. Ĝenevo: Monda Organizaĵo pri Sano, p. 32–42. ISBN 978-92-4156483-0.
- ↑ 8,0 8,1 [http://ftp.iza.org/dp2997.pdf D. Gollin D, C. Zimmermann C: Malaria - Disease Impacts and Long-Run Income Differences (angle), aŭgusto 2007, eldoninto Institute for the Study of Labor, en formato PDF
- ↑ 9,0 9,1 (2005) “Is malaria a disease of poverty? A review of the literature”, Tropical Health and Medicine 10 (10), p. 1047–59. doi:10.1111/j.1365-3156.2005.01476.x.

- ↑ 10,0 10,1 Greenwood BM, Bojang K, Whitty CJ, Targett GA (2005). “Malaria”, Lancet 365 (9469), p. 1487–98. doi:10.1016/S0140-6736(05)66420-3.
- ↑ Fairhurst RM, Wellems TE. (2010) “Chapter 275. Plasmodium species (malaria)”, Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases, 7‑a eldono 2, Philadelphia, Pennsylvania: Churchill Livingstone/Elsevier, p. 3437–62. ISBN 978-0-443-06839-3.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 12,7 12,8 Nadjm B, Behrens RH (2012). “Malaria: An update for physicians”, Infectious Disease Clinics of North America 26 (2), p. 243–59. doi:10.1016/j.idc.2012.03.010.
- ↑ 13,0 13,1 13,2 13,3 13,4 Bartoloni A, Zammarchi L (2012). “Clinical aspects of uncomplicated and severe malaria”, Mediterranean Journal of Hematology and Infectious Diseases 4 (1), p. e2012026. doi:10.4084/MJHID.2012.026.

- ↑ Beare NA, Taylor TE, Harding SP, Lewallen S, Molyneŭ ME (2006). “Malarial retinopathy: A newly established diagnostic sign in severe malaria”, American Journal of Tropical Medicine and Hygiene 75 (5), p. 790–7.

- ↑ Ferri FF. (2009) “Chapter 332. Protozoal infections”, Ferri's Color Atlas and Text of Clinical Medicine. Elsevier Health Sciences. ISBN 978-1-4160-4919-7.
- ↑ 16,0 16,1 Taylor WR, Hanson J, Turner GD, White NJ, Dondorp AM (2012). “Respiratory manifestations of malaria”, Chest 142 (2), p. 492–505. doi:10.1378/chest.11-2655.

- ↑ Korenromp E, Williams B, de Vlas S, Gouws E, Gilks C, Ghys P, Nahlen B (2005). “Malaria attributable to the HIV-1 epidemic, sub-Saharan Africa”, Emerging Infectious Diseases 11 (9), p. 1410–9. doi:10.3201/eid1109.050337.

- ↑ Beare NA, Lewallen S, Taylor TE, Molyneŭ ME (2011). “Redefining cerebral malaria by including malaria retinopathy”, Future Microbiology 6 (3), p. 349–55. doi:10.2217/fmb.11.3.

- ↑ Davidson's Principles and Practice of Medicine ("principoj kaj praktiko de medicino, de Stanley Davidson"), 21-a eldono, p. 351
- ↑ 20,0 20,1 Hartman TK, Rogerson SJ, Fischer PR (2010). “The impact of maternal malaria on newborns”, Annals of Tropical Paediatrics 30 (4), p. 271–82. doi:10.1179/146532810X12858955921032.
- ↑ Rijken MJ, McGready R, Boel ME, Poespoprodjo R, Singh N, Syafruddin D, Rogerson S, Nosten F (2012). “Malaria in pregnancy in the Asia-Pacific region”, Lancet Infectious Diseases 12 (1), p. 75–88. doi:10.1016/S1473-3099(11)70315-2.
- ↑ Mueller I, Zimmerman PA, Reeder JC (2007). “Plasmodium malariae and Plasmodium ovale—the "bashful" malaria parasites”, Trends in Parasitology 23 (6), p. 278–83. doi:10.1016/j.pt.2007.04.009.
- ↑ 23,0 23,1 Collins WE (2012). “Plasmodium knowlesi: A malaria parasite of monkeys and humans”, Annual Review of Entomology 57, p. 107–21. doi:10.1146/annurev-ento-121510-133540.
- ↑ 24,0 24,1 Sarkar PK, Ahluwalia G, Vijayan VK, Talwar A (2009). “Critical care aspects of malaria”, Journal of Intensive Care Medicine 25 (2), p. 93–103. doi:10.1177/0885066609356052.
- ↑ Baird JK (2013). “Evidence and implications of mortality associated with acute Plasmodium vivax malaria”, Clinical Microbiology Reviews 26 (1), p. 36–57. doi:10.1128/CMR.00074-12.
- ↑ Arnott A, Barry AE, Reeder JC (2012). “Understanding the population genetics of Plasmodium vivax is essential for malaria control and elimination”, Malaria Journal 11, p. 14. doi:10.1186/1475-2875-11-14.

- ↑ Collins WE, Barnwell JW (2009). “Plasmodium knowlesi: finally being recognized”, Journal of Infectious Diseases 199 (8), p. 1107–8. doi:10.1086/597415.

- ↑ Parham PE, Christiansen-Jucht C, Pople D, Michael E. (2011) “Understanding and modelling the impact of climate change on infectious diseases”, Climate Change – Socioeconomic Effects, p. 43–66. ISBN 978-9533074115.
Arkivigite je 2014-03-13 per la retarkivo Wayback Machine

- ↑ Climate Change And Infectious Diseases (PDF). CLIMATE CHANGE AND HUMAN HEALTH—RISK AND RESPONSES. Monda Organizaĵo pri Sano.
- ↑ Schlagenhauf-Lawlor 2008, paĝoj 70–1
- ↑ Cowman AF, Berry D, Baum J (2012). “The cellular and molecular basis for malaria parasite invasion of the human red blood cell”, Journal of Cell Biology 198 (6), p. 961–71. doi:10.1083/jcb.201206112.

- ↑ Arrow KJ, Panosian C, Gelband H, Institute of Medicine (U.S.). Committee on the Economics of Antimalarial Drugs. (2004) Saving Lives, Buying Time: Economics of Malaria Drugs in an Age of Resistance. National Academies Press. ISBN 978-0-309-09218-0.
- ↑ Owusu-Ofori AK, Parry C, Bates I (2010). “Transfusion-transmitted malaria in countries where malaria is endemic: A review of the literature from sub-Saharan Africa”, Clinical Infectious Diseases 51 (10), p. 1192–8. doi:10.1086/656806.

- ↑ WHO 2010, p. vi
- ↑ 35,0 35,1 White NJ (2011). “Determinants of relapse periodicity in Plasmodium vivax malaria”, Malaria Journal 10, p. 297. doi:10.1186/1475-2875-10-297.

- ↑ WHO 2010, p. 17
- ↑ 37,0 37,1 Tran TM, Samal B, Kirkness E, Crompton PD (2012). “Systems immunology of human malaria”, Trends in Parasitology 28 (6), p. 248–57. doi:10.1016/j.pt.2012.03.006.
- ↑ 38,0 38,1 38,2 Bledsoe GH (2005). “Malaria primer for clinicians in the United States”, Southern Medical Journal 98 (12), p. 1197–204; quiz 1205, 1230. doi:10.1097/01.smj.0000189904.50838.eb.
- ↑ Vaughan AM, Aly AS, Kappe SH (2008). “Malaria parasite pre-erythrocytic stage infection: Gliding and hiding”, Cell Host & Microbe 4 (3), p. 209–18. doi:10.1016/j.chom.2008.08.010.

- ↑ Richter J, Franken G, Mehlhorn H, Labisch A, Häussinger D (2010). “What is the evidence for the existence of Plasmodium ovale hypnozoites?”, Parasitology Research 107 (6), p. 1285–90. doi:10.1007/s00436-010-2071-z.
- ↑ Tilley L, Dixon MW, Kirk K (2011). “The Plasmodium falciparum-infected red blood cell”, International Journal of Biochemistry and Cell Biology 43 (6), p. 839–42. doi:10.1016/j.biocel.2011.03.012.
- ↑ Mens PF, Bojtor EC, Schallig HDFH (2012). “Molecular interactions in the placenta during malaria infection”, European Journal of Obstetrics & Gynecology and Reproductive Biology 152 (2), p. 126–32. doi:10.1016/j.ejogrb.2010.05.013.
- ↑ Rénia L, Wu Howland S, Claser C, Charlotte Gruner A, Suwanarusk R, Hui Teo T, Russell B, Ng LF (2012). “Cerebral malaria: mysteries at the blood-brain barrier”, Virulence 3 (2), p. 193–201. doi:10.4161/viru.19013.

- ↑ Kwiatkowski DP (2005). “How malaria has affected the human genome and what human genetics can teach us about malaria”, American Journal of Human Genetics 77 (2), p. 171–92. doi:10.1086/432519.

- ↑ 45,0 45,1 Hedrick PW (2011). “Population genetics of malaria resistance in humans”, Heredity 107 (4), p. 283–304. doi:10.1038/hdy.2011.16.

- ↑ Weatherall DJ (2008). “Genetic variation and susceptibility to infection: The red cell and malaria”, British Journal of Haematology 141 (3), p. 276–86. doi:10.1111/j.1365-2141.2008.07085.x.
- ↑ 47,0 47,1 Bhalla A, Suri V, Singh V (2006). “Malarial hepatopathy”, Journal of Postgraduate Medicine 52 (4), p. 315–20.

- ↑ Abba K, Deeks JJ, Olliaro P, Naing CM, Jackson SM, Takwoingi Y, Donegan S, Garner P (2011). “Rapid diagnostic tests for diagnosing uncomplicated P. falciparum malaria in endemic countries”, Cochrane Database of Systematic Reviews (7), p. CD008122. doi:10.1002/14651858.CD008122.pub2.
- ↑ Kattenberg JH, Ochodo EA, Boer KR, Schallig HD, Mens PF, Leeflang MM (2011). “Systematic review and meta-analysis: Rapid diagnostic tests versus placental histology, microscopy and PCR for malaria in pregnant women”, Malaria Journal 10, p. 321. doi:10.1186/1475-2875-10-321.

- ↑ 50,0 50,1 Wilson ML (2012). “Malaria rapid diagnostic tests”, Clinical Infectious Diseases 54 (11), p. 1637–41. doi:10.1093/cid/cis228.
- ↑ Perkins MD, Bell DR (2008). “Working without a blindfold: The critical role of diagnostics in malaria control”, Malaria Journal 1 (Suppl 1), p. S5. doi:10.1186/1475-2875-7-S1-S5.

- ↑ WHO 2010, p. 35
- ↑ WHO 2010, p. v
- ↑ World Health Organization. (1958) “Malaria”, The First Ten Years of the World Health Organization (PDF), Monda Organizaĵo pri Sano, p. 172–87. Arkivita kopio. Arkivita el la originalo je 2011-07-08. Alirita 2015-12-30.
- ↑ Sabot O, Cohen JM, Hsiang MS, Kahn JG, Basu S, Tang L, Zheng B, Gao Q, Zou L, Tatarsky A, Aboobakar S, Usas J, Barrett S, Cohen JL, Jamison DT, Feachem RG (2010). “Costs and financial feasibility of malaria elimination”, Lancet 376 (9752), p. 1604–15. doi:10.1016/S0140-6736(10)61355-4.
- ↑ (13a de Januaro 2015) “Intermittent preventive antimalarial treatment for children with anaemia.”, The Cochrane database of systematic reviews 1, p. CD010767. doi:10.1002/14651858.CD010767.pub2.
- ↑ 57,0 57,1 57,2 Kajfasz P (2009). “Malaria prevention”, International Maritime Health 60 (1–2), p. 67–70.

- ↑ Lengeler C (2004). “Insecticide-treated bed nets and curtains for preventing malaria”, Cochrane Database of Systematic Reviews (2), p. CD000363. doi:10.1002/14651858.CD000363.pub2.
- ↑ Tanser FC, Lengeler C, Sharp BL (2010). “Indoor residual spraying for preventing malaria”, Cochrane Database of Systematic Reviews (4), p. CD006657. doi:10.1002/14651858.CD006657.pub2.
- ↑ . WHO gives indoor use of DDT a clean bill of health for controlling malaria. WHO.
- ↑ 61,0 61,1 Raghavendra K, Barik TK, Reddy BP, Sharma P, Dash AP (2011). “Malaria vector control: From past to future”, Parasitology Research 108 (4), p. 757–79. doi:10.1007/s00436-010-2232-0.
[rompita ligilo]

- ↑ 62,0 62,1 62,2 Howitt P, Darzi A, Yang GZ, Ashrafian H, Atun R, Barlow J, Blakemore A, Bull AM, Car J, Conteh L, Cooke GS, Ford N, Gregson SA, Kerr K, King D, Kulendran M, Malkin RA, Majeed A, Matlin S, Merrifield R, Penfold HA, Reid SD, Smith PC, Stevens MM, Templeton MR, Vincent C, Wilson E (2012). “Technologies for global health”, The Lancet 380 (9840), p. 507–35. doi:10.1016/S0140-6736(12)61127-1.
- ↑ Miller JM, Korenromp EL, Nahlen BL, W Steketee R (2007). “Estimating the number of insecticide-treated nets required by African households to reach continent-wide malaria coverage targets”, Journal of the American Medical Association 297 (20), p. 2241–50. doi:10.1001/jama.297.20.2241.

- ↑ Noor AM, Mutheu JJ, Tatem AJ, Hay SI, Snow RW (2009). “Insecticide-treated net coverage in Africa: Mapping progress in 2000–07”, Lancet 373 (9657), p. 58–67. doi:10.1016/S0140-6736(08)61596-2.
- ↑ 65,0 65,1 Achieving the malaria MDG target: reversing the incidence of malaria 2000-2015.. WHO (September 2015). Arkivita el la originalo je 2016-01-05. Alirita 26-a de decembro 2015. Arkivita kopio. Arkivita el la originalo je 2016-01-05. Alirita 2016-01-10.
- ↑ Schlagenhauf-Lawlor 2008, paĝoj 215
- ↑ (2002) Instructions for treatment and use of insecticide-treated mosquito nets (pdf), World Health Organization.
- ↑ Enayati A, Hemingway J (2010). “Malaria management: Past, present, and future”, Annual Review of Entomology 55, p. 569–91. doi:10.1146/annurev-ento-112408-085423.
- ↑ {{[http://whqlibdoc.who.int/hq/2006/WHO_HTM_MAL_2006.1112_eng.pdf Indoor Residual Spraying: Use of Indoor Residual Spraying for Scaling Up Global Malaria Control and Elimination. WHO Position Statement ("MOS-rekomendo pri la uzo de enĉambra ŝprucigo por tutmonda kontrolo kaj elimino de Malario"), eldoninto Monda Organizaĵo pri Sano, 2006, formato PDF
- ↑ 70,0 70,1 van den Berg H (2009). “Global status of DDT and its alternatives for use in vector control to prevent disease”, Environmental Health Perspectives 117 (11), p. 1656–63. doi:10.1289/ehp.0900785.
- ↑ Pates H, Curtis C (2005). “Mosquito behaviour and vector control”, Annual Review of Entomology 50, p. 53–70. doi:10.1146/annurev.ento.50.071803.130439.
- ↑ Tusting LS, Thwing J, Sinclair D, Fillinger U, Gimnig J, Bonner KE, Bottomley C, Lindsay SW (2013). “Mosquito larval source management for controlling malaria”, Cochrane Database of Systematic Reviews 8, p. CD008923. doi:10.1002/14651858.CD008923.pub2.
- ↑ Enayati AA, Hemingway J, Garner P. (2007). “Electronic mosquito repellents for preventing mosquito bites and malaria infection”, Cochrane Database of Systematic Reviews (PDF) (2), p. CD005434. doi:10.1002/14651858.CD005434.pub2.
- ↑ 74,0 74,1 74,2 Jacquerioz FA, Croft AM (2009). “Drugs for preventing malaria in travellers”, Cochrane Database of Systematic Reviews (4), p. CD006491. doi:10.1002/14651858.CD006491.pub2.

- ↑ Freedman DO (2008). “Clinical practice. Malaria prevention in short-term travelers”, New England Journal of Medicine 359 (6), p. 603–12. doi:10.1056/NEJMcp0803572.

- ↑ Fernando SD, Rodrigo C, Rajapakse S (2011). “Chemoprophylaxis in malaria: Drugs, evidence of efficacy and costs”, Asian Pacific Journal of Tropical Medicine 4 (4), p. 330–6. doi:10.1016/S1995-7645(11)60098-9.
- ↑ (Oct 10, 2014) “Drugs for preventing malaria in pregnant women in endemic areas: any drug regimen versus placebo or no treatment.”, The Cochrane database of systematic reviews 10, p. CD000169. doi:10.1002/14651858.CD000169.pub3.
- ↑ Turschner S, Efferth T (2009). “Drug resistance in Plasmodium: Natural products in the fight against malaria”, Mini Reviews in Medicinal Chemistry 9 (2), p. 206–14. doi:10.2174/138955709787316074.
- ↑ Meremikwu MM, Odigwe CC, Akudo Nwagbara B, Udoh EE (2012). “Antipyretic measures for treating fever in malaria”, Cochrane Database of Systematic Reviews 9, p. CD002151. doi:10.1002/14651858.CD002151.pub2.
- ↑ Kokwaro G (2009). “Ongoing challenges in the management of malaria”, Malaria Journal 8 (Suppl 1), p. S2. doi:10.1186/1475-2875-8-S1-S2.

- ↑ WHO 2010, paĝoj 75–86
- ↑ WHO 2010, p. 21
- ↑ Keating GM (2012). “Dihydroartemisinin/piperaquine: A review of its use in the treatment of uncomplicated Plasmodium falciparum malaria”, Drugs 72 (7), p. 937–61. doi:10.2165/11203910-000000000-00000.
- ↑ Manyando C, Kayentao K, D'Alessandro U, Okafor HU, Juma E, Hamed K (2011). “A systematic review of the safety and efficacy of artemether-lumefantrine against uncomplicated Plasmodium falciparum malaria during pregnancy”, Malaria Journal 11, p. 141. doi:10.1186/1475-2875-11-141.

- ↑ O'Brien C, Henrich PP, Passi N, Fidock DA (2011). “Recent clinical and molecular insights into emerging artemisinin resistance in Plasmodium falciparum”, Current Opinion in Infectious Diseases 24 (6), p. 570–7. doi:10.1097/QCO.0b013e32834cd3ed.

- ↑ Fairhurst RM, Nayyar GM, Breman JG, Hallett R, Vennerstrom JL, Duong S, Ringwald P, Wellems TE, Plowe CV, Dondorp AM (2012). “Artemisinin-resistant malaria: research challenges, opportunities, and public health implications”, American Journal of Tropical Medicine and Hygiene 87 (2), p. 231–41. doi:10.4269/ajtmh.2012.12-0025.

- ↑ Sinclair D, Donegan S, Isba R, Lalloo DG (2012). “Artesunate versus quinine for treating severe malaria”, Cochrane Database of Systematic Reviews 6, p. CD005967. doi:10.1002/14651858.CD005967.pub4.
- ↑ (2014) “Challenges of drug-resistant malaria”, Parasite 21, p. 61. doi:10.1051/parasite/2014059.

- ↑ White NJ (2008). “Qinghaosu (artemisinin): The price of success”, Science 320 (5874), p. 330–4. doi:10.1126/science.1155165.
- ↑ Wongsrichanalai C, Meshnick SR (2008). “Declining artesunate-mefloquine efficacy against falciparum malaria on the Cambodia–Thailand border”, Emerging Infectious Diseases 14 (5), p. 716–9. doi:10.3201/eid1405.071601.
- ↑ Dondorp AM, Yeung S, White L, Nguon C, Day NPJ, Socheat D, von Seidlein L (2010). “Artemisinin resistance: Current status and scenarios for containment”, Nature Reviews Microbiology 8 (4), p. 272–80. doi:10.1038/nrmicro2331.
- ↑ Monda Organizaĵo pri Sano (2013). “Q&A on artemisinin resistance”, WHO malaria publications.
- ↑ Briggs, Helen (30 July 2014) Call for 'radical action' on drug-resistant malaria BBC News, health, Retrieved 30 July 2013
- ↑ (2014) “Spread of artemisinin resistance in Plasmodium falciparum malaria”, New England Journal of Medicine 371 (5), p. 411–23. doi:10.1056/NEJMoa1314981.
- ↑ Frequently Asked Questions (FAQs): If I get malaria, will I have it for the rest of my life?. US Centers for Disease Control and Prevention (February 8, 2010). Alirita 2012-05-14.
- ↑ Trampuz A, Jereb M, Muzlovic I, Prabhu R (2003). “Clinical review: Severe malaria”, Critical Care 7 (4), p. 315–23. doi:10.1186/cc2183.

- ↑ 97,0 97,1 97,2 97,3 Fernando SD, Rodrigo C, Rajapakse S (2010). “The 'hidden' burden of malaria: Cognitive impairment following infection”, Malaria Journal 9, p. 366. doi:10.1186/1475-2875-9-366.

- ↑ 98,0 98,1 Riley EM, Stewart VA (2013). “Immune mechanisms in malaria: New insights in vaccine development”, Nature Medicine 19 (2), p. 168–78. doi:10.1038/nm.3083.
- ↑ 99,0 99,1 Idro R, Marsh K, John CC, Newton CRJ (2010). “Cerebral malaria: Mechanisms of brain injury and strategies for improved neuro-cognitive outcome”, Pediatric Research 68 (4), p. 267–74. doi:10.1203/PDR.0b013e3181eee738.

- ↑ 100,0 100,1 World Malaria Report 2012, Monda Organizaĵo pri Sano, 2012, en formato PDF
- ↑ Olupot-Olupot P, Maitland, K (2013). “Management of severe malaria: Results from recent trials”, Advances in Experimental Medicine and Biology 764, p. 241–50. doi:10.1007/978-1-4614-4726-9_20.
- ↑ 102,0 102,1 102,2 Murray CJ, Rosenfeld LC, Lim SS, Andrews KG, Foreman KJ, Haring D, Fullman N, Naghavi M, Lozano R, Lopez AD (2012). “Global malaria mortality between 1980 and 2010: A systematic analysis”, Lancet 379 (9814), p. 413–31. doi:10.1016/S0140-6736(12)60034-8.
- ↑ (2012) “Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: A systematic analysis for the Global Burden of Disease Study 2010”, Lancet 380 (9859), p. 2095–128. doi:10.1016/S0140-6736(12)61728-0.
- ↑ (16-a de septembro 2015) “The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015”, Nature 526 (7572), p. 207–211. doi:10.1038/nature15535.
- ↑ Layne SP Principles of Infectious Disease Epidemiology (PDF). EPI 220. UCLA Department of Epidemiology. Arkivita el la originalo je 2006-02-20. Alirita 2007-06-15. Arkivigite je 2006-02-20 per la retarkivo Wayback Machine
- ↑ Provost C. "World Malaria Day: Which countries are the hardest hit? Get the full data", The Guardian, April 25, 2011. Kontrolita 2012-05-03.
- ↑ 107,0 107,1 Guerra CA, Hay SI, Lucioparedes LS, Gikandi PW, Tatem AJ, Noor AM, Snow RW (2007). “Assembling a global database of malaria parasite prevalence for the Malaria Atlas Project”, Malaria Journal 6 (1), p. 17. doi:10.1186/1475-2875-6-17.

- ↑ Hay SI, Okiro EA, Gething PW, Patil AP, Tatem AJ, Guerra CA, Snow RW (2010). “Estimating the global clinical burden of Plasmodium falciparum malaria in 2007”, PLoS Medicine 7 (6), p. e1000290. doi:10.1371/journal.pmed.1000290.

- ↑ (2011) “A new world malaria map: Plasmodium falciparum endemicity in 2010”, Malaria Journal 10 (1), p. 378. doi:10.1186/1475-2875-10-378.

- ↑ Feachem RG, Phillips AA, Hwang J, Cotter C, Wielgosz B, Greenwood BM, Sabot O, Rodriguez MH, Abeyasinghe RR, Ghebreyesus TA, Snow RW (2010). “Shrinking the malaria map: progress and prospects”, Lancet 376 (9752), p. 1566–78. doi:10.1016/S0140-6736(10)61270-6.

- ↑ Greenwood B, Mutabingwa T (2002). “Malaria in 2002”, Nature 415 (6872), p. 670–2. doi:10.1038/415670a.
- ↑ Jamieson A, Toovey S, Maurel M. (2006) Malaria: A Traveller's Guide. Struik. ISBN 978-1-77007-353-1.
- ↑ Abeku TA (2007). “Response to malaria epidemics in Africa”, Emerging Infectious Diseases 14 (5), p. 681–6. doi:10.3201/eid1305.061333.

- ↑ Cui L, Yan G, Sattabongkot J, Cao Y, Chen B, Chen X, Fan Q, Fang Q, Jongwutiwes S, Parker D, Sirichaisinthop J, Kyaw MP, Su XZ, Yang H, Yang Z, Wang B, Xu J, Zheng B, Zhong D, Zhou G (2012). “Malaria in the Greater Mekong Subregion: Heterogeneity and complexity”, Acta Tropica 121 (3), p. 227–39. doi:10.1016/j.actatropica.2011.02.016.

- ↑ Machault V, Vignolles C, Borchi F, Vounatsou P, Pages F, Briolant S, Lacaŭ JP, Rogier C (2011). “The use of remotely sensed environmental data in the study of malaria”, Geospatial Health (PDF) 5 (2), p. 151–68. doi:10.4081/gh.2011.167. Arkivigite je 2013-03-12 per la retarkivo Wayback Machine
- ↑ Harper K, Armelagos G (2011). “The changing disease-scape in the third epidemiological transition”, International Journal of Environmental Research and Public Health 7 (2), p. 675–97. doi:10.3390/ijerph7020675.

- ↑ Prugnolle F, Durand P, Ollomo B, Duval L, Ariey F, Arnathau C, Gonzalez JP, Leroy E, Renaud F (2011). “A fresh look at the origin of Plasmodium falciparum, the most malignant malaria agent”, PLoS Pathogens 7 (2), p. e1001283. doi:10.1371/journal.ppat.1001283.

- ↑ Cox F (2002). “History of human parasitology”, Clinical Microbiology Reviews 15 (4), p. 595–612. doi:10.1128/CMR.15.4.595-612.2002.

- ↑ 119,0 119,1 Strong, Richard P. (1944) Stitt's Diagnosis, Prevention and Treatment of Tropical Diseases, ‑a eldono, York, PA: The Blakiston Company, p. 3.
- ↑ "DNA clues to malaria in ancient Rome", BBC News, February 20, 2001. , in reference to Sallares R, Gomzi S (2001). “Biomolecular archaeology of malaria”, Ancient Biomolecules 3 (3), p. 195–213.
- ↑ Sallares R. (2002) Malaria and Rome: A History of Malaria in Ancient Italy. Oxford University Press. doi:10.1093/acprof:oso/9780199248506.001.0001. ISBN 978-0-19-924850-6.
- ↑ Hays JN. (2005) Epidemics and Pandemics: Their Impacts on Human History. Santa Barbara, California: ABC-CLIO. ISBN 978-1-85109-658-9.
- ↑ (1999) “From Shakespeare to Defoe: malaria in England in the Little Ice Age.”, Emerging Infectious Diseases 6 (1), p. 1–11. doi:10.3201/eid0601.000101.
- ↑ Lindemann M. (1999) Medicine and Society in Early Modern Europe. Cambridge University Press. ISBN 978-0-521-42354-0.
- ↑ (2006) The Vector- and Rodent-borne Diseases of Europe and North America: Their Distribution and Public Health Burden. Cambridge University Press. ISBN 978-0-521-85447-4. [rompita ligilo]
- ↑ Webb Jr JLA. (2009) Humanity's Burden: A Global History of Malaria. Cambridge University Press. ISBN 978-0-521-67012-8.
- ↑ The Nobel Prize in Physiology or Medicine 1907: Alphonse Laveran. The Nobel Foundation. Alirita 2012-05-14.
- ↑ Tan SY, Sung H (2008). “Carlos Juan Finlay (1833–1915): Of mosquitoes and yellow fever”, Singapore Medical Journal (PDF) 49 (5), p. 370–1.
- ↑ Chernin E (1983). “Josiah Clark Nott, insects, and yellow fever”, Bulletin of the New York Academy of Medicine 59 (9), p. 790–802.
- ↑ Chernin E (1977). “Patrick Manson (1844–1922) and the transmission of filariasis”, American Journal of Tropical Medicine and Hygiene 26 (5 Pt 2 Suppl), p. 1065–70.
- ↑ The Nobel Prize in Physiology or Medicine 1902: Ronald Ross. The Nobel Foundation. Alirita 2012-05-14.
- ↑ Ross and the Discovery that Mosquitoes Transmit Malaria Parasites. CDC Malaria website. Arkivita el la originalo je 2007-06-02. Alirita 2012-06-14.
- ↑ Simmons JS. (1979) Malaria in Panama. Ayer Publishing. ISBN 978-0-405-10628-6.
- ↑ Kaufman TS, Rúveda EA (2005). “The quest for quinine: Those who won the battles and those who won the war”, Angewandte Chemie (International Edition in English) 44 (6), p. 854–85. doi:10.1002/anie.200400663.
- ↑ Pelletier PJ, Caventou JB (1820). “Des recherches chimiques sur les Quinquinas”, Annales de Chimie et de Physique (French) 15, p. 337–65.
- ↑ Kyle R, Shampe M (1974). “Discoverers of quinine”, Journal of the American Medical Association 229 (4), p. 462. doi:10.1001/jama.229.4.462.
- ↑ Achan J, Talisuna AO, Erhart A, Yeka A, Tibenderana JK, Baliraine FN, Rosenthal PJ, D'Alessandro U (2011). “Quinine, an old anti-malarial drug in a modern world: Role in the treatment of malaria”, Malaria Journal 10 (1), p. 144. doi:10.1186/1475-2875-10-144.

- ↑ Hsu E (2006). “Reflections on the 'discovery' of the antimalarial qinghao”, British Journal of Clinical Pharmacology 61 (3), p. 666–70. doi:10.1111/j.1365-2125.2006.02673.x.

- ↑ Hao, C.. Lasker Award Rekindles Debate Over Artemisinin's Discovery. News: ScienceInsider. Science/AAAS (29a de Septembro 2011).
- ↑ Nobel Prize announcement. Alirita 5a de Oktobro 2015.
- ↑ Vogel V (2013). “Malaria as a lifesaving therapy”, Science 342 (6159), p. 684–7. doi:10.1126/science.342.6159.684.
- ↑ Eradication of Malaria in the United States (1947–1951). US Centers for Disease Control and Prevention (February 8, 2010). Alirita 2012-05-02.
- ↑ Killeen G, Fillinger U, Kiche I, Gouagna L, Knols B (2002). “Eradication of Anopheles gambiae from Brazil: Lessons for malaria control in Africa?”, Lancet Infectious Diseases 2 (10), p. 618–27. doi:10.1016/S1473-3099(02)00397-3.
- ↑ Vanderberg JP (2009). “Reflections on early malaria vaccine studies, the first successful human malaria vaccination, and beyond”, Vaccine 27 (1), p. 2–9. doi:10.1016/j.vaccine.2008.10.028.

- ↑ Humphreys M. (2001) Malaria: Poverty, Race, and Public Health in the United States. Johns Hopkins University Press. ISBN 0-8018-6637-5.
- ↑ (2002) “The economic and social burden of malaria”, Nature 415 (6872), p. 680–5. doi:10.1038/415680a.
- ↑ Roll Back Malaria WHO partnership (2003) Economic costs of malaria (PDF). Monda Organizaĵo pri Sano.
- ↑ Ricci F (2012). “Social implications of malaria and their relationships with poverty”, Mediterranean Journal of Hematology and Infectious Diseases 4 (1), p. e2012048. doi:10.4084/MJHID.2012.048.

- ↑ (2006) “Counterfeit and substandard antimalarial drugs in Cambodia”, Transactions of the Royal Society of Tropical Medicine and Hygiene 100 (11), p. 1019–24. doi:10.1016/j.trstmh.2006.01.003.
- ↑ (2008) “A collaborative epidemiological investigation into the criminal fake artesunate trade in South East Asia”, PLoS Medicine 5 (2), p. e32. doi:10.1371/journal.pmed.0050032.

- ↑ (2006) “Counterfeit anti-infective drugs”, Lancet Infectious Diseases 6 (9), p. 602–13. doi:10.1016/S1473-3099(06)70581-3.

- ↑ Parry J (2005). “WHO combats counterfeit malaria drugs in Asia”, British Medical Journal 330 (7499), p. 1044. doi:10.1136/bmj.330.7499.1044-d.

- ↑ (2009) “Spurious and counterfeit drugs: A growing industry in the developing world”, Postgraduate Medical Journal 85 (1003), p. 251–6. doi:10.1136/pgmj.2008.073213.
- ↑ (2008) “Substandard medicines in resource-poor settings: A problem that can no longer be ignored”, Tropical Medicine & International Health 13 (8), p. 1062–72. doi:10.1111/j.1365-3156.2008.02106.x.

- ↑ (2012) “Poor-quality antimalarial drugs in southeast Asia and sub-Saharan Africa”, Lancet Infectious Diseases 12 (6), p. 488–96. doi:10.1016/S1473-3099(12)70064-6.
- ↑ Russell PF. (January 6, 2009) “Communicable diseases Malaria”, Medical Department of the United States Army in World War II. U.S. Army Medical Department. Office of Medical History. Arkivita kopio. Arkivita el la originalo je 2012-10-09. Alirita 2016-07-20.
- ↑ Melville CH. (1910) “The prevention of malaria in war”, The Prevention of Malaria. New York, New York: E.P. Dutton.
- ↑ Lénaick Ollivier de l'Institut de médecine tropicale du service de santé des armées (IMTSSA Marseille), citita laŭ Le Figaro la 10-an de junio 2008, paĝo 16.
- ↑ Bray RS. (2004) Armies of Pestilence: The Effects of Pandemics on History. James Clarke. ISBN 978-0-227-17240-7.
- ↑ Byrne JP. (2008) Encyclopedia of Pestilence, Pandemics, and Plagues: A-M. ABC-CLIO. ISBN 978-0-313-34102-1. [rompita ligilo]
- ↑ Strom S. "Mission Accomplished, Nonprofits Go Out of Business", April 1, 2011. Kontrolita 2012-05-09.
- ↑ Fighting AIDS, Tuberculosis and Malaria. The Global Fund. Arkivita el la originalo je 2011-07-03. Alirita 2012-05-09.
- ↑ Schoofs M (July 17, 2008) Clinton foundation sets up malaria-drug price plan. Wall Street Journal. Alirita 2012-05-14.
- ↑ Executive summary and key points. World Malaria Report 2013. World Health Organization. Alirita 13a de Februaro 2014.
- ↑ World Malaria Report 2013. World Health Organization. Alirita 13a de Februaro 2014.
- ↑ (2010) Medical Geography, 3‑a eldono, Guilford Press, p. 120–3. ISBN 978-1-60623-016-9.
- ↑ Williams LL (1963). “Malaria eradication in the United States”, American Journal of Public Health and the Nation's Health 53 (1), p. 17–21. doi:10.2105/AJPH.53.1.17.

- ↑ (2012) “History of malaria research and its contribution to the malaria control success in Suriname: A review”, Malaria Journal 11, p. 95. doi:10.1186/1475-2875-11-95.

- ↑ (2012) “Malaria control in Bhutan: Case study of a country embarking on elimination”, Malaria Journal 11, p. 9. doi:10.1186/1475-2875-11-9.

- ↑ "Britain and Bill Gates pledge 3 billion pounds to fight malaria", Reuters, 25a de Januaro 2016. Kontrolita 25-a de januaro 2016.
- ↑ Bylaws of the Global Fund to Fight AIDS, Tuberculosis & Malaria. The Global Fund to Fight AIDS, Tuberculosis and Malaria. Alirita 28a de Januaro, 2016.
- ↑ GFATM - The Global Fund to Fight AIDS, Tuberculosis and Malaria. Swiss Agency for Development and Cooperation SDC. Alirita 23a de Majo, 2018.
- ↑ (2009-12-01) “Malaria Control, Elimination, and Eradication: The Role of the Evolving Biomedical Research Agenda”, Journal of Infectious Diseases (en) 200 (11), p. 1639–1643. doi:10.1086/646611.
- ↑ WHO | A research agenda for malaria eradication. Alirita 2016-03-07.
- ↑ 175,0 175,1 Hill AVS (2011). “Vaccines against malaria”, Philosophical Transactions of the Royal Society B 366 (1579), p. 2806–14. doi:10.1098/rstb.2011.0091.

- ↑ (2011) “European Vaccine Initiative: Lessons from developing malaria vaccines”, Expert Review of Vaccines (PDF) 10 (12), p. 1697–708. doi:10.1586/erv.11.158.
- ↑ (2010) “Advances and challenges in malaria vaccine development”, Journal of Clinical Investigation 120 (12), p. 4168–78. doi:10.1172/JCI44423.

- ↑ (2006) “Vaccines for preventing malaria (blood-stage)”, Cochrane Database of Systematic Reviews (4), p. CD006199. doi:10.1002/14651858.CD006199.

- ↑ (2006) “Vaccines for preventing malaria (SPf66)”, Cochrane Database of Systematic Reviews (2), p. CD005966. doi:10.1002/14651858.CD005966.

- ↑ (2010) “Development of a metabolically active, non-replicating sporozoite vaccine to prevent Plasmodium falciparum malaria”, Human Vaccines 6 (1), p. 97–106. doi:10.4161/hv.6.1.10396.

- ↑ [http://www.malariavaccine.org/files/Malaria_Vaccine_TRM_Final_000.pdf |publisher=PATH Malaria Vaccine Initiative (MVI) |format=PDF}}
- ↑ (2010) “Malaria, Plasmodium falciparum and its apicoplast”, Biochemical Society Transactions 38 (3), p. 775–82. doi:10.1042/BST0380775.
- ↑ (2010) “Vitamin B metabolism in Plasmodium falciparum as a source of drug targets”, Trends in Parasitology 26 (1), p. 35–43. doi:10.1016/j.pt.2009.10.006.
- ↑ (2011) “Thiamin (vitamin B1) biosynthesis and regulation: A rich source of antimicrobial drug targets?”, International Journal of Biological Sciences 7 (1), p. 41–52. doi:10.7150/ijbs.7.41.

- ↑ (2012) “The therapeutic potential of metal-based antimalarial agents: Implications for the mechanism of action”, Dalton Transactions 41 (21), p. 6335–49. doi:10.1039/C2DT12247B.
- ↑ (2012) “Ferrocene-based antimalarials”, Future Medicinal Chemistry 4 (6), p. 783–97. doi:10.4155/fmc.12.26.
- ↑ 187,0 187,1 Carroll John (8a de Decembro 2014). New malaria drug unleashes an immune system assault on infected cells. fiercebiotechresearch.com. Alirita 16a de Decembro 2014.
- ↑ (2002) “Anopheles gambiae genome: completing the malaria triad”, Science 298 (5591), p. 13. doi:10.1126/science.298.5591.13.
- ↑ (2002) “Transgenic anopheline mosquitoes impaired in transmission of a malaria parasite”, Nature 417 (6887), p. 452–5. doi:10.1038/417452a.
- ↑ (23a de Novembro 2015) “Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito”, Proceedings of the National Academy of Sciences, p. 201521077. doi:10.1073/pnas.1521077112. Alirita 24a de Novembro 2015..
- ↑ Flam, Faye, "Fighting Zika Virus With Genetic Engineering", Bloomberg, 4a de Februaro 2016.
- ↑ (2006) “Evolutionary origins of human malaria parasites”, Malaria: Genetic and Evolutionary Aspects. New York, New York: Springer, p. 125–46. ISBN 978-0-387-28294-7.
- ↑ Baird JK. (2009). “Malaria zoonoses”, Travel Medicine and Infectious Disease 7 (5), p. 269–77. doi:10.1016/j.tmaid.2009.06.004.
- ↑ Ameri M (2010). “Laboratory diagnosis of malaria in nonhuman primates”, Veterinary Clinical Pathology 39 (1), p. 5–19. doi:10.1111/j.1939-165X.2010.00217.x.
- ↑ (2008) “Transgenic rodent Plasmodium berghei parasites as tools for assessment of functional immunogenicity and optimization of human malaria vaccines”, Eukaryotic Cell 7 (11), p. 1875–9. doi:10.1128/EC.00242-08.

- ↑ (2012) “Ecology and conservation biology of avian malaria”, Annals of the New York Academy of Sciences 1249, p. 211–26. doi:10.1111/j.1749-6632.2011.06431.x.
Vidu ankaŭ[redakti | redakti fonton]
Eksteraj ligiloj[redakti | redakti fonton]
- http://mosquito.who.int/malariacontrol Arkivigite je 2006-01-06 per la retarkivo Wayback Machine
- http://www.cdc.gov/malaria
- http://www.malariavaccine.org
- http://www.newscientist.com/news/news.jsp?id=ns99996537